Sztöchimetria – OKTV feladatok
Vissza a sztöchiometria témakörre!
3/o-1 (2006/1/12/5)
Egy barnakőminta mangán(IV)-oxid-tartalmát úgy határozták meg, hogy a finoman elporított barnakő 0,2500 g-jához 0,4095 g kristályvíztartalmú oxálsavat (H2C2O4·2 H2O) adtak, majd 20 cm3 1,0 mol/dm3-es kénsavval addig melegítették, míg a sötétszínű barnakőrészek teljesen fel nem oldódtak mangán(II)-só keletkezése közben. Az oxálsav feleslegét 0,100 mol/dm3-es kálium-permanganát-oldattal titrálták meg savas közegben, a fogyás 2,11 cm3-nek adódott.
a) Írja fel a végbemenő folyamatok rendezett reakcióegyenletét!
b) Adja meg a barnakő tömegszázalékos mangán(IV)-oxid-tartalmát!
Ar(C) = 12,0; Ar(H) = 1,0; Ar(O) = 16,0; Ar(Mn) = 54,9
3/o-2 (2006/1/12/7)
Ismeretlen szerves vegyület 0,2700 g-ja 0,6474 g ezüstöt választ ki az ezüsttükör-próba során. Ugyanekkora tömegű minta tökéletes égéséhez 220,5 cm3 standard nyomású, 25 oC-os oxigéngáz szükséges. Az égés során keletkező víz tömege 0,162 g.
a) Mi a vegyület molekulaképlete?
b) Írja fel a vegyület szerkezeti képletét is, ha tudjuk, hogy molekulája egy királis szénatomot tartalmaz!
Ar(Ag) = 107,9; Ar(C) = 12,0; Ar(H) = 1,00; Ar(O) = 16,0; Vm = 24,5 dm3/mol
3/o-3 (2007/1/12/2)
Egy természetben is megtalálható, vízben rosszul oldódó, fehér színű vegyület 2,11 grammját vizsgáljuk. Melegítés hatására bomlik, 500 oC felett már nincs további gázfejlődés. A keletkező színtelen, szagtalan gáz telített meszes vízben fehér csapadék kiválását okozza. A visszamaradó fehér színű anyag 50,0 cm3 2,00 mol/dm3-es sósavban oldható fel.
a) Adja meg az ismeretlen vegyület összegképletét és nevét!
b) Írja fel a végbemenő folyamatok reakcióegyenletét!
3/o-4 (2007/1/12/4)
Egy piritet, ként és meddőt tartalmazó kőzetből 25000 kg-ot pörkölve, majd katalizátoros oxidációnak alávetve 25,71 m3 SO3 gáz keletkezik 105 Pa nyomáson és 500 oC-on. A piritből és a kénből azonos tömegű kén-trioxid lesz. A keletkező SO3-gáz 98,0 tömegszázalékos kénsavban 85
a) Írja fel a lejátszódó folyamatok kémiai egyenletét
b) Mi a tömegszázalékos összetétele a kőzetnek?
c) Mekkora térfogatú víz szükséges a hígításhoz?
3/o-5 (2008/1/12/4)
A kalcium-karbid egyik érdekes gyakorlati alkalmazása betonok nedvességtartalmának meghatározása, amire például betonpadlóra ragasztott parketták készítése során van szükség.
A módszer a következő: a padlóból vett betonmintát porrá törve speciális zárt tartályban acélgolyók segítségével por alakú kalcium-karbiddal keverik össze. A beton víztartalmával ez gázt fejleszt, és kalcium-hidroxiddá alakul. A reakció hatására megnövekedik a tartályban mérhető nyomás. Ebből kiszámítható a gáz mennyisége és a minta víztartalma.
Egy vizsgálat során a következő mérési eredményeket kapták. Egy helyiség padlójából vett 25,0 g betonpor-mintát vizsgálva a fejlődő gáz a műszer 500,0 cm3 térfogatú tartályában, 20 oC hőmérsékleten 135,2 kPa nyomásnövekedést okozott. A parketta legfeljebb 2 tömegszázalék nedvességtartalmú aljzatbetonra ragasztható fel.
a) Írja fel a lejátszódó reakciót!
b) Elkezdheti-e a kivitelező a munkát, vagy még szárítani kell a helyiség padlóját?
3/o-6 (2008/1/12/6)
A fertőtlenítőszerek ún. aktív klórtartalma jellemzi az adott anyag „hatékonyságát”. Az aktív klórtartalom azt adja meg, hogy hány gramm klór képes ugyanannyi jódot kiválasztani jodidionokból, mint 100 g vizsgált anyag. Az egyik legelterjedtebb fertőtlenítőszer a klórmész, amit úgy állítanak elő, hogy oltott mészbe a sztöchiometrikus mennyiségnél kevesebb klórt vezetnek, majd a keletkező fehér szilárd anyagot elkülönítik. Ez mindig tartalmaz vizet is.
Egy klórmész minta aktív klórtartalma a vizsgálatok szerint 39,0
a) Adja meg a klórmész előállításakor lejátszódó reakció egyenletét!
Milyen ionokat tartalmaz a klórmész?
Mi az anionok anyagmennyiség-aránya a mintában?
Speciális célokra (pl. a tejiparban) használnak fertőtlenítőként egy fém-hipokloritot, amelyet kétszeres tömegű inert (nem oxidáló hatású) anyaggal összekeverve 40,5
b) Melyik fém hipokloritjáról van szó?
3/o-7 (2008/1/12/8)
Egy kristályvizes fémsó elemanalízise alapján azt tudjuk, hogy egyéb más elemek mellett 32,57 tömegszázalékban tartalmaz oxigént, 5,70 tömegszázalékban hidrogént és 13,07 tömegszázalékban ként. Enyhe hevítés után a vegyület oxigéntartalma 40,10 tömegszázalék, kéntartalma 20,11 tömegszázalék lett, és hidrogént nem lehetett kimutatni benne.
Adja meg a vegyület képletét!
3/o-8 (2009/1/12/1)
Egy kétkomponensű ötvözetben a vas és a másik fém anyagmennyiségének aránya 2:3.
Miközben az ötvözet 7,00 g-os részletét sósavban maradéktalanul feloldjuk, 4,17 dm3 standard állapotú hidrogén gáz keletkezik.
Melyik fém az ötvözet másik összetevője?
Írja fel a lejátszódó folyamatok egyenletét!
3/o-9 (2009/1/12/2)
A portlandcement egyik legfontosabb (a gyors megszilárdulás szempontjából előnyös) összetevője egy kalciumot, szilíciumot és oxigént tartalmazó vegyület, amely 35,04 tömegszázalék oxigént tartalmaz. Számítással határozza meg a vegyület összegképletét!
M(O) = 16,00 g/mol, M(Si) = 28,09 g/mol, M(Ca) = 40,06 g/mol
3/o-10 (2009/1/12/6)
Egy kísérletben 1,00 g, 2,00 g és 4,00 g tömegű megtisztított kalciumdarabkákat dobtak azonos térfogatú 20,0 tömeg
Amikor a kalciumdarabka tömegét 1,00 g-ról megkétszerezték, pontosan kétszer annyi lett a keletkező termék. Amikor tovább kétszerezték a kalciumdarabka tömegét (4,00 g-ra), már csak 1,607-szeresre nőtt a kapott termék tömege.
Mekkora volt a sósavminták térfogata?
M(H) = 1,008 g/mol, M(O) = 16,00 g/mol, M(Cl) = 35,46 g/mol, M(Ca) = 40,06 g/mol
3/o-11 (2009/1/12/8)
A C-vitamin tabletták jó része nem csak aszkorbinsavat (azaz C-vitamint), hanem nátriumaszkorbátot is tartalmaz. A hatóanyagtartalmat azonban minden esetben aszkorbinsavban kifejezve adják meg. Az aszkorbinsav egy hat szénatomos monoszacharid-származék, mely szénen kívül csak hidrogént és oxigént tartalmaz.
Egy 100 mg hatóanyag-tartalmú készítményben a címke szerint 33,5 mg aszkorbinsav mellett 74,8 mg nátrium-aszkorbát található.
a) Számítással határozza meg az aszkorbinsav moláris tömegét!
b) Számítással határozza meg az aszkorbinsav és a nátrium-aszkorbát összegképletét!
c) Hány mg nátrium-aszkorbátot tartalmaz egy 500 mg hatóanyag-tartalmú tabletta, ha aszkorbinsav-tartalma 220 mg?
3/o-12 (2015/1/12/1)
Egy kristályvízmentes Na2SO4-ból és K2SO4-ból álló porkeveréket desztillált vízben feloldottunk, majd az oldathoz feleslegben BaCl2-oldatot öntöttünk. A levált csapadék tömegét szűrés és tömegállandóságig történő hevítés után megmérve azt tapasztaltuk, hogy az a kiindulási porkeverék tömegének 1,50-szerese. Mi volt a kiindulási keverék tömegszázalékos összetétele?
3/o-13 (2015/1/12/3)
Egy nátrium-szulfid-oldat koncentrációjának meghatározásához az oldat 20,03 cm3-es részletéhez 20,00 cm3 0,204 mol/dm3 koncentrációjú kénsavoldatot adunk, majd az oldatból fülke alatt kiforraljuk a kén-hidrogén teljes mennyiségét. Lehűtés után 0,106 mol/dm3 koncentrációjú nátrium-hidroxid-mérőoldattal metilvörös indikátor jelenlétében titráljuk a kénsav feleslegét. A fogyás 8,58 cm3. Hány gramm nátrium-szulfidot tartalmaz az eredeti oldat literenként?
3/o-14 (2006/2/2/2)
Az M fém a duralumíniumba kerülő egyik ötvözőanyag. Adott körülmények között heves reakcióba lép az X, Y és Z gázokkal is.
X és M reakciójában egy elem és egy vegyület fekete, szilárd keveréke keletkezik (1).
A keverék összetevői közül A sósav-oldatban feloldódik, és C vegyület vizes oldatát kapjuk, a visszamaradó B viszont oldhatatlannak bizonyul más oldószerekben is. Csak a savmegkötő anyagnak használt A keletkezik viszont az M fém és az Y gáz reakciójában (2).
A Z gázzal reagálva a fém a C vegyületet képezi (3), aminek 25,5
Nátrium-hidroxid hatására C vizes oldatából a tiszta vízben rosszul oldódó D vegyület válik ki. (4).
D-ből hevítés hatására víz és A keletkezik (5).
Az X gáz és A keletkezik hevítés hatására az E vegyületből (6).
a) Milyen anyagokat jelölnek az M, X, Y, Z, A, B, C, D és E betűk?
b) Írja fel a hat, számozott folyamat egyenletét!
3/o-15 (2006/2/2/4)
5,000 g tömegű fémport 100,0 cm3 réz(II)-szulfát-oldatba szórunk, majd az oldat teljes elszíntelenedése után a szilárd anyagot leszűrjük, megmérjük a tömegét, ami 4,511 g-nak adódik. A szűrés után az oldathoz feleslegben bárium-klorid-oldatot öntünk, a keletkező csapadék tömege 2,334 g. Milyen anyagi minőségű fémport szórtunk az oldatba?
Ar(Cu) = 63,5; Ar(Ba) = 137,3; Ar(S) = 32,1; Ar(O) = 16,0
3/o-16 (2006/2/2/6)
Két azonos szénatomszámú, folyékony szerves vegyületet (A és B) vizsgálunk, melyekben a jód barna színnel oldódik. Az A vegyület nátriummal gázfejlődés közben reagál, réz(II)-oxid hatására pedig B vegyületté alakítható magas hőmérsékleten. B vegyület csak erélyes módszerekkel oxidálható. Az oxidáció termékeiből két folyékony halmazállapotú (C és E), valamint egy gáz halmazállapotú (D) vegyület volt csak elkülöníthető. C moláris tömege nagy pontossággal A moláris tömegével egyezik meg. Az A vegyület széntartalma 64,82
Milyen anyagokat jelölnek az A, B, C, D és E betűk?
Ismertesse a megoldás gondolatmenetét!
Ar(H) = 1,01; Ar(C) = 12,01; Ar(O) = 16,0;
3/o-17 (2006/2/2/7)
A benzol toxicitásának felfedezése előtt a vegyipar nagy tételben állított elő klór-benzolt benzol közvetlen katalitikus klórozásával, folyamatos üzemben. Az alábbi ábrán egy ilyen üzem blokk-vázlatát látjuk. A reaktorba óránként 5 tonna „friss” benzolt adagolnak.
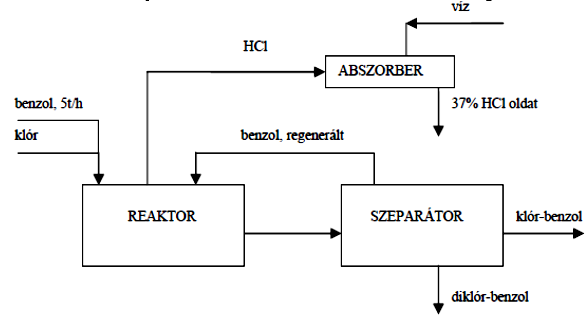
Mivel a benzolból sok klór jelenlétében diklór-benzolok is képződnek (melynek előállítása nem cél), a reakció során 1,00 mol benzolra csak 0,400 mol klórgáz jut. Ilyenkor 0,394 mol klórbenzol és 0,003 mol diklór-benzol keletkezik. A reaktorból a termékelegyet folyamatosan a szeparátorra vezetik, ahol folyamatos üzemben desztillációval elválasztják az át nem alakult benzolt, a terméket és a nem kívánt diklór-benzol mellékterméket. A benzolt visszavezetik a reaktorba. A reakció során keletkező HCl-ot annyi vízben nyeletik el, hogy 37,0 tömegszázalékos oldat keletkezzék, melyet a WC-tisztítószer ipar irányába értékesítenek.
a) Írja fel a klór-benzol képződésének egyenletét!
b) Óránként hány tonna klór-benzolt termel az üzem?
c) Hány tonna klórt kell adagolni a reaktorba óránként?
d) Hány liter/perc sebességgel kell a HCl-abszorberbe adagolni a vizet?
e) Hány kg/perc sebességgel áramlik a szeparátorból a visszanyert benzol a reaktor felé?
Az alkalmazott katalizátor (vízmentes vas(III)-klorid) mellett csak orto- és paradiklórbenzol keletkezik, 1:1,4 arányban. A para-diklórbenzol „globol” néven molyirtóként volt népszerű a hatvanas években.
f) A klórbenzol gyár melléküzemágát napi hány „ötdekás” zacskó „globol” molyirtó kiszerelésére kell méretezni? (24 órában folyik a termelés.)
3/o-18 (2007/2/2/1)
A molibdén gyakorlatilag egyetlen ásványa a molibdenit (MoS2). Ipari feldolgozása soránelőször levegőn pörkölik. A kapott technikai MoO3-ot vas-szilícium ötvözettel redukálva kapják a metallurgiában adalékként használatos nagy molibdéntartalmú vasötvözetet. A redukciós reakcióban csak a szilícium vesz részt.
a) Írja fel a molibdenit pörkölésének rendezett reakcióegyenletét! 3/o-19 (2007/2/2/4) Határozzuk meg az alább vázolt folyamatokban A – G betűkkel jelölt anyagok képletét és nevét, ha tudjuk, hogy A egy elemet jelöl! Írjuk fel a kémiai reakciók rendezett egyenleteit is! A + O2 → B B + H2O → KOH + C + D KMnO4 + C + H2SO4 → E + K2SO4 + H2O + D K2Cr2O7 + C + H2SO4 → F + K2SO4 + H2O + D F + KClO3 + KOH → G + KCl + K2SO4 + H2O K2Cr2O7 + KOH ↔ G + H2O 3/o-20 (2007/2/2/5) Az A szénhidrogén képlete С9Н10. Ez a vegyület a) Mi az A vegyület szerkezeti képlete és elnevezése? 3/o-21 (2008/2/2/2) A légköri levegő CO2-tartalma 0,03 térfogat
1,00 dm3 25 °C hőmérsékletű standardnyomású levegő CO2 tartalmát elnyelettük 75,00 cm3 telített Ca(OH)2-oldatban. A megfelelő reakcióidő eltelte után az oldat tisztájából 25,00 cm3-t megtitráltunk 0,010 mol/dm3 koncentrációjú HCl-oldattal fenolftalein indikátor mellett. A fogyás 2,63 cm3 volt. Emellett a telített meszesvíz 25,00 cm3-ét is hasonló módon titráltuk. Erre a 0,010 mol/dm3 koncentrációjú HCl-oldatból 5,40 cm3 fogyott. a) Mekkora volt a vizsgált levegő CO2-tartalma térfogat
b) Növekszik-e a légzésintenzitás ilyen összetételű levegőben? 3/o-22 (2008/2/2/6) Egy ismeretlen anyag (mely a vizsgálatok szerint csak kétféle atomot tartalmaz) bizonyos tömegű mintájából 1,000 dm3 oldatot készítettek. Az oldat 100,0 cm3-éhez fölöslegben kalcium-nitrát-oldatot öntve 1,952 g csapadék válik le. Az oldat másik, szintén 100,0 cm3-es mintájához fölöslegben kalcium-klorid-oldatot öntve viszont 9,120 g csapadék keletkezik, amelynek 10,99 tömeg
Ar(Ca) = 40,08; Ar(Cl) = 35,45 3/o-23 (2008/2/2/7) Közel 20 évnyi erőfeszítés után, 1999-ben a chicagói egyetem kutatóinak sikerült előállítaniuk egy igen különleges szerves vegyületet. Ha ebből az anyagból 1,000·10–3 mólt, azaz 464,1 mg-ot elhelyezünk egy levákuumozott, zárt, nyomásálló tartályban, melynek hasznos térfogata 1,000 dm3, majd a mintát felhevítjük, heves robbanás játszódik le. A tartályban 481,0 K hőmérsékleten 4,79·104 Pa nyomás mérhető, amely 2,973·104 Pa-ra csökken, ha a tartály 298,0 K-re hűl. Tömény lúgoldaton átvezetve a keletkezett gázelegyet, tömege 75,86
Ha az előző kísérletet úgy végezzük el, hogy a tartályban kezdetben 294,3 K hőmérsékletű 1,040·105 Pa nyomású oxigén is van (mintánk tömege továbbra is 464,1 mg), akkor 503,0 K hőmérsékleten 2,279·105 Pa, 296,4 K-en pedig 1,343·105 Pa nyomás mérhető a reakció lezajlása után. Ennek a gázelegynek a tömege 19,30
a) Számítással határozzuk meg a vizsgált anyag összegképletét! 3/o-24 (2009/2/2/4) Kristályvízmentes kálium-hidrogén-oxalát és vas(II)-oxalát elegyét tartalmazó porminta 1,000 g-os részletét 20 tömegszázalékos kénsavoldatban feloldjuk. A mintát desztillált vízzel meghígítjuk, majd 0,2000 mol/dm3-es kálium-permanganát oldattal megtitráljuk. A fogyás 19,28 cm3. Mi a minta tömegszázalékos összetétele? 3/o-25 (2009/2/2/5) Egy sárgaréz mintát tömény kénsavban feloldva, pontosan ugyanolyan térfogatú, azonos állapotú gáz keletkezett, mint amikor ismeretlen töménységű salétromsavban oldottuk fel a minta egy másik, azonos tömegű részletét. (A sárgaréz réz és cink ötvözete.) A kénsavas oldás során tiszta gáz keletkezett, a salétromsavas oldás során pedig egy kétkomponensű gázkeverék. A salétromsavas oldás után visszamaradó oldat 15,0-15,0 tömegszázalékos mindkét sóra és 30,0 tömegszázalékos salétromsavra nézve. a) Adja meg az ötvözet tömegszázalékos összetételét! 3/o-26 (2009/2/2/8) Egy ismeretlen nem változó vegyértékű fém oxidjának és karbonátjának keverékét tömegállandóságig hevítve a keverék tömege az eredetinek 86,32
a) Határozza meg az ismeretlen fémet! Ar(C) = 12,0 Ar(O) = 16,0 Ar(H) = 1,00 3/o-27 (2010/2/2/2) A redoxireakción alapuló térfogatos meghatározások egyik kevésbé ismert módszere a cerimetria, amely a Ce4+ ionok erélyes oxidáló hatásán alapul: Ce4+ + e– → Ce3+ Cérium(IV)-mérőoldatot legcélszerűbben vízmentes ammónium-cérium(IV)-nitrátból közvetlen beméréssel készíthetünk. 1,000 dm3 0,0100 mol/dm3 koncentrációjú mérőoldathoz 5,481 g sóra van szükség. a) Határozza meg az ammónium-cérium(IV)-nitrát összegképletét! A vércukorszint meghatározásának korábban használatos módszere cerimetriás titrálás volt. A vizsgálatok szerint a Ce4+ megfelelő körülmények között pontos és egyértelmű sztöchiometria szerint kvantitatíve hangyasavvá oxidálja a glükózt. b) Írja fel a reakció egyenletét! 3/o-28 (2010/2/2/7) Egy egyenes láncú szénhidrogén tökéletes elégetésekor kapott égéstermékeket CaCl2-ot, majd KOH-ot tartalmazó csövön vezették át. A CaCl2-os cső tömege 1,0 grammal, a KOH-ot tartalmazóé 3,26 grammal gyarapodott. A szénhidrogén egy mólját 3 mol H2 telíti, nátriummal hidrogénfejlődés mellett reagál, geometriai izomerei nincsenek. Számítással határozza meg a szénhidrogén összegképletét, és rajzolja fel a szerkezetét! 3/o-29 (2010/2/2/8) „A Karl Fischer által kidolgozott vízmeghatározási térfogatos analitikai eljárás mind a mai napig általánosan használt. A meghatározás azon alapul, hogy a kén-dioxidnak elemi jóddal való reakciójához vízre van szükség. Tehát a vízhez képest feleslegben adagolva a kéndioxidot és a jódot, a reakció végbemenetelének mértékét a víz határozza meg. A titrálásnál oldószerként a vízmentes metanol szolgál, és a reakcióban keletkezett sav megkötésére piridin van az oldatban.” (Burger Kálmán: A mennyiségi kémiai analízis alapjai) A fenti anyagokból készített mérőoldatot a módszer kidolgozójáról Karl Fischer-reagensnek nevezzük. A mérőoldat „vízértékének” meghatározása céljából a következő mérést végezzük. 500,0 ml-es mérőlombikba 2,325 g vizet mérünk, térfogatát 394,5 g „vízmentes” metanollal 500,0 ml-re egészítjük ki. Az így elkészült oldatból 10,00 ml-eket pipettázunk három Erlenmeyer-lombikba. Három másik Erlenmeyer-lombikba 10,00 – 10,00 ml „vízmentes” metanolt mérünk be. A fogyások az első esetben: 11,53 ml; 11,59 ml; 11,50 ml. A fogyások a második esetben: 2,21 ml; 2,25 ml; 2,26 ml. A mérés során használt „vízmentes” metanol sűrűsége 0,7920 g/cm3. a) Írja fel a folyamat reakcióegyenletét! 3/o-30 (2011/2/2/2) A száraz szalma elemi összetétele 50,0 tömegszázalék szén, 6,0 tömegszázalék hidrogén és 44,0 tömegszázalék oxigén. Tekintsünk egy biomassza-erőművet, mely óránként 20,0 tonna szalmát éget el! Az égetéshez szükséges levegőt egy levegőkompresszor juttatja be az égéstérbe. A beszívott levegő hőmérséklete –20 és +40 oC, nyomása pedig 98 és 103 kPa között változhat. Hány m3/óra teljesítményre kell méretezni a levegőkompresszort, ha az égetés során 10
3/o-31 (2011/2/2/5) A múlt festőművészeinek széles körben használt festékanyaga volt az ólomfehér, ami egy bázisos ólom(II)-karbonát, összetétele közelítőleg a Pbx(CO3)y(OH)z képlettel adható meg. Napjainkban inkább titán-dioxiddal helyettesítik, az ólomfehér ugyanis reakcióba lép a levegő esetleges kén-hidrogén-szennyezésével, ez pedig a festmények megfeketedését okozza. Az ólomfehéret levegőn 500 oC körüli hőmérsékleten tartósan hevítve, kémiai reakció játszódik le, amelyben egy másik gyakran használt vörös festékanyag, a mínium (Pb3O4) képződik. Ólomfehér 6,11 grammos mintáját levegőn hevítve 5,40 g mínium keletkezik. a) Határozza meg a festékanyag hozzávetőleges képletét (vagyis az ionok anyagmennyi-ségarányát a vizsgált mintában)! 3/o-32 (2011/2/2/7) Az összetett szénhidrátok szerkezetvizsgálatának egyik klasszikus módszere az ún. kimerítő metilezés. Az eljárás lényege, hogy megfelelő körülmények között a szénhidrát-molekula minden hidroxilcsoportját metoxicsoporttá (CH3O–) alakítják. Ezt a származékot savas hidrolízisnek vetik alá, majd szétválasztják a keletkező termékeket, és meghatározzák mennyiségüket. A savas hidrolízis során csak a glikozidos hidroxilcsoportok által létrehozott éterkötések (az ún. glikozidkötések) hidrolizálnak. Az eljárással információt nyerhetünk a monoszacharidok kapcsolódási módjáról és a vizsgált szénhidrát molekulatömegéről is. A növényvilág legelterjedtebb tartaléktápanyaga, a keményítő kétféle poliszacharidot tartalmaz: amilózt és amilopektint. Az α-D-glükóz „monomerek” mindkét szerkezetben 1–4 glikozidkötéssel kapcsolódnak egymáshoz, az amilopektinben azonban átlagosan 24-30 glükózegységenként elágazás is található, 1–6 típusú glikozidkötés révén. Egy rizsből izolált amilózminta kimerítő metilezése, majd az azt követő savas hidrolízise során A és B glükózszármazékok képződnek 624:1 anyagmennyiség-arányban. a) Rajzolja fel A és B szerkezeti képletét! (A kiralitáscentrumok konfigurációját nem kell jelölnie.) 3/o-33 (2012/2/2/2) A mangán(II)-nitrát hőbomlását az alábbi reakcióegyenlettel szokás leírni: Mn(NO3)2 → MnO2 + 2 NO2 Valójában a keletkező mangán-oxid összetétele általában nem felel meg az MnO2 összegképletnek, az O/Mn arány kisebb, mint 2. Egy kísérletben azt tapasztalták, hogy a vízmentes mangán(II)-nitrát 200 oC-on történő hevítése során 52,04
a) Mi a keletkező szilárd anyag összegképlete? (Azaz mennyi x értéke az MnOx képletben?) 3/o-34 (2012/2/2/3) 1,000 gramm kálium-kromát – kálium-dikromát keveréket kevés desztillált vízben oldunk, majd az oldatot 100,0 cm3-re egészítjük ki. Ebből az oldatból kimérünk 10,00 cm3-t, 0,5 g kálium-jodidot és 20 cm3 20
I– + CrO42– + …… → I2 + Cr3+ + …… I– + Cr2O72– + …… → I2 + Cr3+ + …… A keletkezett elemi jódot 0,100 mol/dm3 koncentrációjú Na2S2O3-oldattal titráljuk. A rendezendő egyenlet: I2 + S2O32– → I– + S4O62– Mennyivel tér el a keverékre kapott tömegszázalékos kálium-kromát-tartalom a valóságostól, ha a titrálás során véletlenül a szükségesnél 0,10 cm3-rel többet adagolunk a tioszulfát-mérőoldatból? 3/o-35 (2012/2/2/5) Az Egyesült Államokban mára gyakorlatilag megszűnt a hagyományos, kősóból és mészkőből kiinduló Solvay-féle szódagyártás, mert az igények teljes mértékben kielégíthetők természetes forrásból: a föld mélyén ugyanis óriási készletek rejtőznek egy trona nevű ásványból. Ha a szennyezésektől mentes tronát enyhén, 120 oC körüli hőmérsékleten huzamosabb ideig hevítjük, 29,66
Az elemanalízis szerint a tiszta trona – ami egy egyértelmű összetétellel jellemezhető sószerű, kristályos vegyület – 56,63 tömegszázalék oxigént tartalmaz. Határozza meg a trona összegképletét! 3/o-36 (2016/2/2/6) A kristályvizes réz(II)-jodát [Cu(IO3)2∙xH2O] oldhatósága: 112 mg / 100 g oldat. A telített réz(II)-jodát-oldat 10,00 cm3-ét (melynek sűrűségét tekinthetjük 1,00 g/cm3-nek) savas közegben feleslegben vett KI-dal reagáltatjuk, majd a kivált jódot 0,0503 mol/dm3 koncentrációjú nátrium-tioszulfát-oldat segítségével titráljuk keményítő indikátort alkalmazva. A fogyás értéke 6,71 cm3. A titrálás során lejátszódó reakciók kiegészítendő egyenletei: Cu2+ + I– = CuI + I2 a) Rendezze a megadott egyenleteket! Az oldhatósági szorzat (L) az alábbi képlettel számolható, ahol a [] az adott ion koncentrációját jelöli a telített oldatban: L = [Cu2+]·[IO3–]2 3/o-37 (2013/2/2/2) A siitake gombából (Lentinula edodes) izolálták a lentionin nevű, jellegzetes fokhagymaszagú anyagot, melynek szerkezete nagyon meglepte a kutatókat, ugyanis hasonló vegyület a természetben igen ritkán fordul elő. A lentioninban szénen és hidrogénen kívül csak egyféle heteroatom található. A lentionin 244,9 mg-ját tiszta oxigénben elégetve, az égéstermék 46,84 mg vizet tartalmaz. Az égéstermékként kapott gázelegy a híg kálium-jodidos jódoldatot elszínteleníti. Egy másik 244,9 mg-os mintából kapott égésterméket hidrogén-peroxid-oldatban elnyeletve, majd kiforralva, abból bárium-klorid-oldattal híg savban oldhatatlan csapadék válik le, melynek tömege 1,517 g. A lentionin molekulatömegéből tudjuk, hogy összegképlete megegyezik a tapasztalati képletével. a)Milyen heteroatomot tartalmaz a lentionin? 3/o-38 (2013/2/2/3) A vas(II)-oxid kősó típusú rácsban kristályosodik. Vizsgálatok szerint az anyag nem pontosan követi elvi összetételét, hanem képlete Fe1–xO formában adható meg, ahol x értéke mintáról mintára változik, és akár 0,12 is lehet. Az eltérés oka, hogy a kristályban szabályosan elhelyezkedő oxidionok között néhány Fe2+-ion helye üresen marad. A hiányzó töltés kompenzálására Fe3+ ionok is beépülnek akristályrácsba, de nem a Fe2+ ionok helyére. A Fe2+-helyek hány százaléka betöltetlen abban az anyagban, amelynek összetételét az Fe0,92O összegképlet írja le? 3/o-39 (2014/2/2/2) Az etanolt feleslegben levő kénsavas kálium-dikromát- (K2Cr2O7–) oldattal oxidálni lehet, de a folyamat nem pillanatreakció. Termékként króm(III)-szulfát és ecetsav keletkezik. A reakció időbeli lefolyását a színes dikromátionok koncentrációját vagy a keverék pH-ját megfigyelve lehet követni. a) Mi a reakció egyenlete? Egy 50 cm3-es reakcióelegyből 5,0 cm3 mintát vettek a reakció kezdetén, a reagensek összekeverése utáni pillanatban. További 5,0 cm3-es mintákat vettek 60 másodperc, majd további egy óra elteltével. A mintákat azonnal 50 cm3 0,500 mol/dm3 koncentrációjú NaOH-oldathoz adták. A feleslegben levő bázis az oldatban levő savas anyagokkal reagálva azonnal leállítja az oxidációs reakciót. Az így kapott keverékeket 0,500 mol/dm3 koncentrációjú sósavval titrálták. A kezdeti mintára 12,3 cm3, a harmadikra 45,9 cm3 sósav fogyott. Az elegy színét vizsgálva a reakció első percében a dikromátionok koncentrációcsökkenése 0,162 mol/(dm3∙min) volt. b) Mennyi volt a kénsav és az etanol koncentrációja a kezdeti elegyben? 3/o-40 (2014/2/2/5) A szilícium hidrogénvegyületei, az ún. szilánok a szénhidrogénekhez képest sokkal kevésbé stabil vegyületek. Szobahőmérsékleten a monoszilán (SiH4) stabilis gáz, bár sokkal reakcióképesebb, mint a vele analóg metán. Oxigénnel például hevesen reagál. Tíz atomnál hosszabb Si-Si láncokat tartalmazó szilánokat – az alkánokkal ellentétben – nem sikerült előállítani. A monoszilánt metanollal megfelelő arányban reagáltatva két termék keletkezik. Az egyik egy gáz, amelynek sűrűsége azonos állapotban 16-od része a monoszilánénak. A másik egy alacsony forráspontú folyadék; 100 cm3 25 °C-os és 0,1 MPa nyomású monoszilánból elvileg 375,5 mg ilyen anyag állítható elő. a) Számítással határozza meg a reakciótermékek képletét, és írja fel a folyamat reakció-egyenletét! A monoszilán katalizátor (AlI3) jelenlétében már –50 °C körüli hőmérsékleten reagál hidrogén-jodiddal egyszerű szubsztitúciós reakcióban. Egy kísérletben 0,1352 g monoszilánból kiindulva 0,5056 g keletkezett a reakció főtermékéből. Ez a monoszilánra nézve 76,0
b) Határozza meg a reakció főtermékének képletét, és írja fel a reakció egyenletét! 3/o-41 (2014/2/2/7) A vízmentes magnézium-bromid előállítására a következő egyszerű módszert szokták használni. Vízmentes dietil-éterbe finom magnéziumport szórnak és hozzá 1,2-dibróm-etánt csepegtetnek. Az elegy felforr, és etiléngáz távozik. A reakció lejátszódása után az oldatot bepárolják, és így egy fehér porhoz jutnak. A fehér por 100,0 mg-os részletét 100 cm3 desztillált vízben oldjuk; hozzáadunk 10 cm3 tömény kénsavat, majd forrkövet dobunk bele, és forrás közben titráljuk 0,0200 mol/dm3 koncentrációjú KMnO4-mérőoldattal: a fogyás 7,74 cm3. Mi a fehér por pontos összetétele? A titrálási folyamat kiegészítendő egyenlete: MnO4– + Br– + H+ → Mn2+ + Br2 + H2O 3/o-42 (2014/2/2/8) Az alanin aminosav etil-alkoholban nem oldódik. Ha 50 g alaninra 200 cm3 etil-alkoholt öntünk, majd az elegybe HCl-gázt vezetünk, akkor azt tapasztaljuk, hogy az alanin lassan feloldódik. Erről az oldatról az alkohol feleslegét elpárologtatva 86,2 g fehér, kristályos anyag marad vissza. a) Adja meg a keletkezett termék szerkezeti képletét! A) sóképzés B) hidrolízis C) elimináció D) észterképzés E) éterképzés Az így nyert anyagot vízben feloldjuk, majd az oldat pH-ját NaOH segítségével 10-re állítjuk. Megfigyelhetjük, hogy a lúgosítás hatására a kezdetben szagtalan oldat alkoholszagú lesz. Így egy olyan anyagot kapunk, melynek képlete C6H10N2O2. c) Írja fel a termék szerkezeti képletét! 3/o-43 (2015/2/2/2) Egy ismeretlen elem 1,000 g-ját oxigénfeleslegben elégettük, majd a kapott 1,233 g tömegű anyagot feleslegben vett kénsavval reagáltattuk. Ennek hatására fehér csapadék vált ki az oldatból. A csapadék fölötti oldathoz KI-oldatot öntve, majd az oldat fölé benzint rétegezve és az elegyet összerázva a benzines fázisban lila szín megjelenését tapasztaltuk. a) Mi volt a kiindulási elem? Állítását számítással igazolja! 3/o-44 (2015/2/2/5) Egy ásványvíz kalcium- és magnéziumion-tartalmát komplexometriás titrálással határoztuk meg. 50,0 cm3 térfogatú mintát 0,0510 mol/dm3 koncentrációjú EDTA-oldattal titráltunk (az etilén-diamin-tetraecetsav dinátriumsója, amely a kalcium- és a magnéziumionokkal is 1:1 arányban képez komplexet). A titrálás végpontjának jelzéséhez kevés eriokrómfekete-T indikátort használtunk, amely szintén komplexet képez a mérendő fémionokkal, de kisebb stabilitásút, mint az EDTA. Az indikátor szabad állapotban kék, fémionokkal alkotott komplexének színe pedig lilás rózsaszín. Az EDTA szabadon is és a komplexekben is színtelen. a) Milyen színű az indikátort tartalmazó oldat a titrálás elején? A) kezdődő színváltozásig B) átmeneti színig C) állandó szín eléréséig Az EDTA-oldatból a titráláshoz 4,92 cm3 fogyott. d) Összesen hány mmol kalcium- és magnéziumiont tartalmazott az 50,0 cm3 ásványvíz? Ugyanennek az ásványvíznek 100,0 cm3-es részletét metilvörös indikátor mellett sósavval titrálva meghatározható a hidrogén-karbonát-tartalma is: a 0,0993 mol/dm3 koncentrációjú sósavból 8,04 cm3 fogyott. f) Mennyi az ásványvíz változó keménysége német keménységi fokban? 3/o-45 (2015/2/2/8) Ha egy fém oldódik valamilyen savban, szinte mindig gáz fejlődik. Érdekes kivétel ez alól az ón viselkedése hideg híg salétromsavoldatban, ugyanis a fém lassan ugyan, de gázfejlődés nélkül oldódik fel. Egy kísérletben 0,500 dm3 0,100 tömegszázalékos salétromsavoldatba (sűrűsége 0,998 g/cm3) beledobunk egy kis óndarabkát. A reakció lejátszódása után a kapott oldat kisebb részleteiben meghatározzuk bizonyos ionok koncentrációját. Azt találjuk, hogy az ón teljes koncentrációja (mégpedig kizárólag ón(II) formájában) 2,325 mmol/dm3, a nitrátionok koncentrációja pedig 15,26 mmol/dm3 lesz. (Az oldódás során bekövetkező térfogatváltozás elhanyagolható.) a) Hány gramm ónt oldottunk fel? 3/o-46 (2016/2/2/2) Egy elemet klórral reagáltatva a trikloridjának és a pentakloridjának keveréke keletkezett. A keverék 81,0 m/m
Melyik elemből indultunk ki, és mi a triklorid és a pentaklorid tömegaránya a képződött termékelegyben? 3/o-47 (2016/2/2/3) Négy kísérletben 1,00 mol/dm3 koncentrációjú ecetsav- és 0,50 mol/dm3 koncentrációjú Na2CO3-oldatokat öntünk össze az alábbiak szerint: (1) 1,00 liter ecetsavoldathoz 1,00 liter Na2CO3-oldatot öntünk lassan, folyamatos keverés közben. Érdekes megfigyelés, hogy az első két kísérlet tapasztalatai nem azonosak, holott csak az adagolás sorrendje különbözik. Az egyik esetben kezdettől fogva gázfejlődést tapasztalunk, a másik esetben viszont csak az adagolt oldat felének hozzáöntése után jelennek meg buborékok. a) Milyen gáz fejlődik? A kísérletek során nyert oldatokat szobahőmérsékleten nyitott edényben állni hagyjuk addig, amíg további tömegcsökkenés már nem tapasztalható. Az így nyert kristályokat ezután 130 °C-on hevítjük. A hevítés során az (1) és (2) esetben 39,7
c) Milyen anyag kristályosodott ki az oldatokból az (1), (2), ill. (3) esetben? Válaszát számítással igazolja!
b) Írja fel a molibdén-oxid redukciójának rendezett reakcióegyenletét!
c) Hány kg molibdén-oxid redukálható 0,840 tonna 50 tömegszázalékos vas-szilícium ötvözet segítségével? Ha az eljárás 82
b) Írja fel a három reakció termékeit!
c) Mely termék(ek)nek léteznek sztereoizomerei és hány darab?
c) Írjuk fel a lejátszódó reakciók egyenletét!
b) Adjuk meg a vizsgált anyag hőbomlásának (1. kísérlet) és égésének (2. kísérlet) egyenletét!
c) Mi lehet a vizsgált anyag szerkezete, ha tudjuk, hogy molekulája nem tartalmaz szénszén többszörös kötéseket?
Írja fel a lejátszódó folyamatok egyenleteit!
b) Mely gáz(ok) keletkeztek és milyen térfogatszázalékos összetételben a savas oldódások során?
c) Milyen töménységű salétromsavban oldottuk a mintát?
b) Számítsa ki a kiindulási keverék tömeg
c) Mekkora volt annak a vérnek a glükóz-koncentrációja (mmol/dm3 egységben kifejezve), amelynek 1,0 cm3-ére 6,24 cm3 0,0100 mol/dm3 koncentrációjú cérium(IV)- mérőoldat fogyott?
d) Hogyan viszonyulna a számított és a valós vércukorszint egymáshoz, ha a vérben a glükózon kívül más oxidálható anyagok is lennének?
b) Határozza meg a mérőoldat vízértékét, azaz, hogy a mérőoldat 1,00 ml-e hány mg vizet mér!
c) Hány tömegszázalék vizet tartalmazott a „vízmentes” metanol?
d) 20,00 ml „vízmentes” metanolba 0,876 g glicerint mérünk. A titrálás végpontjáig 10,87 ml Karl Fischer-reagens fogy. Hány tömegszázalék vizet tartalmazott a glicerin?
b) Írja fel a festékanyag szennyezett levegőn történő megfeketedésének, valamint hevítésének reakcióegyenletét!
b) Számítsa ki a vizsgált amilóz átlagos moláris tömegét!
c) A-n és B-n kívül keletkezik-e más glükózszármazék az amilopektin metilezés utáni hidrolízise során? Ha igen, rajzolja fel a szerkezeti képletét!
d) Az amilopektin vizsgálata során A és B anyagmennyiség-aránya más lesz, mint az amilóz esetén. Kisebb vagy nagyobb n(A) / n(B) arányt várunk? Válaszát indokolja!
e) A vizsgált eljárással kaphatunk-e információt a szénhidrát glikozidkötéseinek térállásáról (vagyis arról, hogy a felépítő monoszacharidok glikozidos hidroxilcsoportja α vagy β helyzetű)? Válaszát indokolja!
f) Létezhet-e olyan összetett szénhidrát, amelyből a kimerítő metilezést követő savas hidrolízissel csak egyetlen terméket kapunk? Ha igen, javasoljon ilyen szerkezetet!
b) A bomlás során egy másik gáz is keletkezik a NO2 Mi ez a gáz? Milyen térfogatarányban képződtek a gázok ebben a kísérletben?
IO3– + I– + H+ = I2 + H2O
S2O32– + I2 = S4O62– + I–
b) Hány mól vízzel kristályosodik a réz(II)-jodát 1mólja?
c) Határozza meg, az ún. oldhatósági szorzat értékét a réz(II)-jodátra!
b)Állapítsa meg a lentionin összegképletét!
c)Határozza meg a molekula szerkezetét, ha tudjuk, hogy a molekula gyűrűs szerkezetű, nem tartalmaz elágazást és szén-szén kötést, valamint minden heteroatom legalább egy másikkal is létesít kötést!
c) Mekkora fogyás várható a második minta esetén?
b) Milyen típusú reakció(k) játszódik (játszódnak) le?
b) Írja fel a lejátszódott reakciók egyenletét!
b) Milyen színű lesz az oldat, ha a titráló oldatból túl sokat (az ekvivalens mennyiségnél többet) adagolunk?
c) Meddig kell adagolni a mérőoldatot a pontos meghatározáshoz?
e) Mennyi az ásványvíz keménysége német keménységi fokban kifejezve? (1 német keménységi fok a keménysége annak a vízmintának, amelynek 1 literében 10 mg kalcium-oxid kalciumtartalmával azonos anyagmennyiségű kalcium- és magnéziumion van összesen.)
b) Adja meg az ón oldódásának reakcióegyenletét! Válaszát számítással támassza alá!
(2) 1,00 liter Na2CO3-oldathoz 1,00 liter ecetsavoldatot öntünk lassan, folyamatos keverés közben.
(3) 1,00 liter ecetsavoldathoz 0,50 liter Na2CO3-oldatot öntünk lassan, folyamatos keverés közben.
(4) 1,00 liter Na2CO3-oldathoz 0,50 liter ecetsavoldatot öntünk lassan, folyamatos keverés közben.
b) Melyik esetben figyelhető meg kezdettől fogva gázfejlődés? A megfelelő számmal válaszoljon!
d) A többi kísérlet tapasztalatai alapján várhatóan mi a (4) kísérlet során kapott oldatból kikristályosodó anyag összetétele és tömege?
e) A d) feladatban említett anyagot 130 °C-on hevítve hány