Sztöchiometria – FEB-es feladatok
Vissza a sztöchiometria témakörre!
3/f-1 Oxidációs számok alapján rendezd a következő egyenleteket!
- FeCl3 + SnCl2 = FeCl2 + SnCl4
- MnO4– + Cl– + H+ = Mn2++ Cl2 + H2O
- HgCl2 + SnCl2 = Hg2Cl2 + SnCl4
- P4 + HNO3 = H3PO4 + NO
- Cr2O3 + KNO3 + KOH = K2CrO4 + KNO2
- Fe2+ + NO3– + H+ = Fe3+ + NO
- MnSO4 + NaOH + KNO3 = Na2MnO4 + Na2SO4 + KNO2
- KClO3 + KI + H2SO4 = K2SO4 + KCl + I2
- Na2TeO3 + NaI + HCl = NaCl + Te + H2O + I2
- H2O2 + KMnO4 + HCl = MnCl2 + H2O + O2 + KCl
- Cr2O3 + Na2CO3 + NaNO3 = Na2CrO4 + NaNO2 + CO2
- MnO + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
- K2Cr2O7 + KI + H2SO4 = Cr2(SO4)3 + I2 + K2SO4 + H2O
- I2 + SO2 + H2O = I– + SO42- + H+
- KMnO4 + NaNO2 + H2SO4 = K2SO4 + MnSO4 + NaNO3
- Bi2S3 + NO3– = Bi3+ + NO + S
- Na2CrO4 + KI + H2SO4 = Cr2(SO4)3 + I2 + Na2SO4 + K2SO4
- NO3– + Zn + OH– = NH3 + [Zn(OH)4]2–
- KMnO4 + C6H12O6 + H2SO4 = K2SO4 + MnSO4 + CO2
- Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2
- KMnO4 + MnSO4 + ZnO = MnO2 + K2SO4 + ZnSO4
- Fe + HNO3 (híg) = Fe(NO3)3 + NO + H2O
- (NH4)2Cr2O7 = Cr2O3 + N2 + H2O
- BaO2 + H2SO4 = H2O2 + BaSO4
- FeS + HNO3 = Fe(NO3)3 + S + NO
- Cu2+ + I– = CuI + I2
- CuS + HNO3 = Cu(NO3)2 + NO2 + H2SO4
- Sn + HNO3 = Sn(NO3)2 + NH4NO3 + H2O
- Fe3O4 + HCl = FeCl3 + FeCl2 + H2O
- KClO3 + H2SO4 = K2SO4 + KClO4 + ClO2
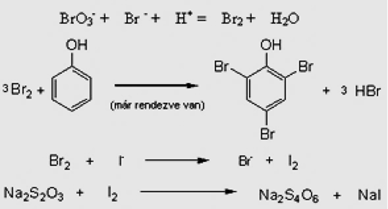
- BrO3‑ + Br – + H+ = Br2 + H2O
- P2H4 = PH3 + P4H2
- S + NaOH = Na2S + Na2S2O3
- NO2 + NaOH = NaNO3 + NaNO2 + H2O
- KClO3 = KCl + KClO4
- As2S3 + NH4OH + H2O2 = (NH4)3AsO4 + (NH4)2SO4 + H2O
- AgNO3 + AsH3 + H2O = Ag + H3AsO4 + HNO3
- FeS2 + O2 = Fe2O3 + SO2
3/f-2 40 tömeg
M (Cu) = 63,5 g M (Zn) = 65,4 g
3/f-3 Magnézium-, kalcium- és bárium- karbonátból álló keverék 1,1200 g-ját 520 °C-ra hevítjük. Ekkor csak a magnézium- karbonát bomlik. A hevítés során 35,3 cm3 standardállapotú szén- dioxid gáz fejlődik. A visszamaradt anyagot 20,00 cm3 2,000 mol/dm3 –es sósavval reagáltatjuk, és a szén- dioxid eltávolítása után 100 cm3– re egészítjük ki az oldatot. Ebből a törzsoldatból 10,00 cm3 –t kimérve 0,1150 mol/dm3– es nátrium- hidroxid- oldattal titráljuk a savfelesleget, a fogyás 19,40 cm3. Számítsd ki a poreverék n/n
3/f-4 Ismeretlen tömegű BaCl2 . xH2O kristályt 50 ml desztillált vízhez (ρ=1 g/cm3) adagoltunk 20 °C-on. Ezen a hőmérsékleten nem oldódott fel az összes kristály, a telített oldattal BaCl2 . 2 H2O tart egyensúlyt. Az oldatot leszűrtük, a szilárd anyag tömegét megmértük: 1,28 g volt. Az oldatot 0 °C-ra hűtöttük, ekkor újabb kristálykiválás (BaCl2 . 2 H2O) következett be. Szűrés után az összes szilárd anyagból 100 ml törzsoldatot készítettünk desztillált vízzel, melynek 10-10 cm3-es részleteit AgNO3– oldattal (c=0,2 mol/dm3, f=0,997) titráltuk, az átlagfogyás 18,15 ml volt.
Mekkora volt az ismeretlen minta tömege?
Hány kristályvízzel kristályosodott a kiindulási anyag?
Oldhatóságok: 20 °C: 35,7 g BaCl2/100 g víz, 0 °C: 30,7 g BaCl2/ 100 g víz
3/f-5 20 °C-on telített nátrium- karbonát-oldat 14,69 g-jához pontosan 25,00 cm3 3,0025 mol/dm3– es sósavat mérünk. A reakció befejeztével- az összes szén- dioxid eltávozása után- 250,0 cm3 törzsoldatot készítünk belőle, majd ebből 10-10 cm3-t körülbelül 0,1 mol/dm3 koncentrációjú NaOH- oldattal titrálunk, az átlagfogyás 10,50 cm3. A NaOH- oldat pontos koncentrációjának meghatározására a 3,0025 mol/dm3–es sósav 10,00 cm3–éből 250 cm3 törzsoldatot készítünk, melynek 10 cm3-et megtitráljuk a körülbelül 0,1 mol/dm3-es NaOH- oldattal, az átlagfogyás 12,12 cm3.
Határozd meg a NaOH- oldat pontos koncentrációját! Mekkora tömegű nátrium- karbonátot tartalmazott a kiadott minta? Milyen m/m
3/f-6 10 mol HCl-t 1000 g vízben oldunk. Az oldat 1000 g-hoz 200 g Ba(OH)2-t adunk. Mi lesz a reakció után az elegy mólszázalékos összetétele? MBa(OH)2=171 g/mol MHCl=36,5 g/mol 3/f-7 Róka az oroszlányi uszoda sósavtartalmát szeretné meghatározni titrálással, ami az alábbi kiegészítendő egyenlet szerint játszódik le: K2Cr2O7 + HCl = KCl + CrCl3 + Cl2 a) Az uszoda vizének 10,0 cm3-es részletére 11,5 cm3, 0,02 mol/dm3-es K2Cr2O7-oldat fogyott. Milyen koncentrációjú a víz sósavra nézve? b) Másnapra változott a sósavtartalom, ezért újra meg kellett titrálni. Viszont most Soma gonosz volt, és meglökte Róka kezét titrálás közben. Így a 10 cm3-es mintához 20,0 cm3 0,02 mol/dm3 K2Cr2O7 oldatot adott. A felesleg meghatározásához a dikromátionokat KI hozzáadásával redukálta, majd a képződött jód mennyiségét Na2S2O3 segítségével határozta meg. A tioszulfátos titrálás során 8,5 cm3 0,1 mol/dm3-es Na2S2O3-oldat fogyott. Mennyi volt a sósav koncentrációja a második napon? Cr2O72- + I–+ H+ = Cr3++ I2+ H2O I2 + Na2S2O3 = NaI + Na2S4O6 Az egyenleteket rendezni kell! 3/f-8 Az oxigén fejlesztéshez Gábor az alábbi rendezendő reakcióegyenlet alapján hajtott végre reakciót(a szükséges víz nem elfelejtendő): KMnO4 + H2O2 + H2SO4= MnSO4 + K2SO4 + O2 Hány dm3 0 °C-os atmoszféra nyomású O2 gázt sikerült Gábornak fejlesztenie, ha csak 201,3 g permanganátból indultunk ki? A robbantáshoz 2 l-es palack áll rendelkezésre és tudjuk, hogy a légköri nyomás 5x-ösét bírja ki. 17 ºC-on hány g KMnO4 –t kell használnunk, hogy még éppen ne robbanjon fel Gábor kezében a palack? M(KMnO4)=158 g/mol M(H2SO4)=98 g/mol M(H2O2)=34 g/mol 3/f-9 Virág és Kata a gyerekekkel sóskafőzeléket készít, és kíváncsiak a szertárban található sóska-aroma (H2C2O4 ∙ x H2O) kristályvíztartalmára. Ezért a szilárd porból bemértek 0,6021 g-ot és 100,0 ml oldatot készítettek belőle. Ennek 10,0 ml-es részletét 0,0200 M-os f=1,068 faktorú KMnO4 mérőoldattal titrálták, az átlagos fogyás 10,10 ml lett. Hány mol kristályvizet tartalmaz a szertárban lévő oxálsav? A kiegészítendő reakcióegyenlet: (COOH)2 + KMnO4 + H2SO4 = CO2 + MnSO4 + K2SO4 M(H2C2O4)=90,03 g/mol 3/f-10 Zsolti az esti kísérletezés során cinket és alumíniumot 2:3 tömegarányban öntötte össze és a keletkező keverék 5,00 g-ját NaOH-oldattal reagáltatta. Ezen kívül tudjuk, hogy Zsolti 174 cm magas és 80 kg és 20 óra 13 perckor hajtotta végre a kísérletet. Segítsetek Zsoltinak és adjátok meg, hogy mekkora térfogatú standard állapotú gáz fejlődött! 3/f-11 A FEB táboros Hát Izsák huncotkodó vegyész technikus egy óvatlan pillanatban beszabadul a kémia szertárba. Rövid ideje volt a kipenderítésig, de gyorsan talált 5 g Fe-at és 60
Fe + H2SO4 = FeSO4 + H2 a) Mekkora az alkalmazott H2SO4 -oldat molkoncentrációja ( mol/dm3) ? b) Az oldásnál hány dm3 H2SO4 -oldatot használt fel? Mekkora az oldatban (az oldás után) a FeSO4 moltörtje ha feltételezzük, hogy a H2 gáz teljesen eltávozott? (Figyelem a H2SO4-et 5
3/f-12 18,6 g tömegű, magnézium-kloridból (MgCl2), fém magnéziumból (Mg) és magnézium-karbonátból (MgCO3) álló keverékhez híg kénsavat adunk, és ekkor 5,08 liter (dm3) térfogatú, 0 °C hőmérsékletű, 101,325 kPa nyomású gázkeverék keletkezik. Mennyi a keverék klórtartalma, ha összes magnézium-tartalma 45,71 tömeg
(Relatív atomtömegek: Mg: 24; Cl: 35,5; C: 12; H: 1; O: 16.) 3/f-13 200 kg 88,4
NaIO3 + NaHSO3 + Na2CO3 = I2 + Na2SO4 + CO2 3/f-14 Zn-Cu ötvözet 2 grammját sósavban oldjuk. Hány tömeg
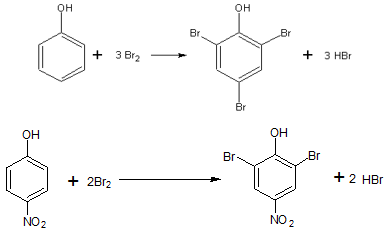
3/f-15 Fenol és p-nitrofenol keverékének összetételét határozzuk meg az alábbi eljárással. A keverék 220 mg-jából törzsoldatot készítünk egy 100 cm3-es mérőlombikban. Ebből 10,00-10,00 cm3-eket mérünk ki kétjelű pipetta és Griffin-labda segítségével csiszolatos Erlenmeyer-lombikokba. Minden részlethez 0,8 g szilárd KBr-ot és 20 cm3 2 M kénsavat adunk, valamint 20 cm3 1/60 M-os KBrO3-oldatot pipettázunk. A lombikokat ledugózzuk, várunk 20 percet (elmegyünk hadijátékozni), majd 1-1 g KI-ot adunk az oldatokhoz. Újra lezárjuk a lombikokat és várunk 15 percet. Végül 0,1 M-os 0,937-es faktorú nátrium-tioszulfát-mérőoldattal megtitráljuk, a végpont előtt 10 csepp keményítő indikátort adva az oldatokhoz. A kapott fogyások: 11,25 cm3, 11,30 cm3 és 11,25 cm3. Mi a keverék összetétele? KBrO3 + KBr + H2SO4 = Br2 + H2O + K2SO4 Br2 + I– = Br– + I2 I2 + S2O32- → I– + S4O62- 3/f-16 Ismeretlen koncentrációjú K2CrO4-oldat 200 ml-ből kiveszünk 10,00 cm3-es részleteket és ezekhez adunk feleslegben vett KI-ot, majd az oldatot megsavanyítjuk. A keletkezett I2-ot 0,200 mol/dm3-es tioszulfáttal (S2O32-) titráljuk. A fogyások átlaga 24,00 cm3. a) Mekkora a kiindulási 200 ml-es oldat koncentrációja K2CrO4-ra nézve? b) Mennyi az oldott anyag tömege? A rendezendő egyenletek: CrO42- + I– + H+ = I2 + Cr3+ + H2O S2O32- + I2 = I– + S4O62- 3/f-17 Fenolt (C6H6O) határozunk meg. 15 cm3 mintából 100 cm3 törzsoldatot készítünk. Az ebből vett 10 cm3-es mintába 1 g KBrO3-ot és felesleges mennyiségű KBr-ot adunk. A keletkezett bróm a fenollal reagál, ezt követően feleslegben KI-ot adunk az oldatba. A keletkezett jódot 22,5 cm3 0,02 M Na2S2O3 oldattal tudtuk megtitrálni. Mennyi volt a fenol molaritása (mól/dm3) az eredeti oldatban? (Ar(C)=12, Ar(O)=16, Ar(H)=1) 3/f-18 10g Na2CO3 és NaHCO3 szilárd porkeveréket sósavval kezelnek. Feleslegben használt sósav hatására a lejátszódott reakció után az elegyet szárazra párolják (csak NaCl marad). Az így keletkezett termék tömege pontosan annyi, mint a kiindulási keverék tömege volt. Számítsuk ki a kiindulási keverék tömeg
Milyen mólarányban keverték össze a két vegyületet? Na2CO3 + 2 HCl = 2 NaCl + CO2 + H2O NaHCO3 + HCl = NaCl + CO2 + H2O M(Na2CO3) = 106 g/mol M(NaHCO3) = 84 g/mol. 3/f-19 1 liter 0,5 mólos HBr oldat elkészítéséhez hány g 20
P + Br3 = PBr3 PBr3 + H2O = H3PO3 + HBr 3/f-20 Egy cink- magnézium porkeverék híg sósavból 8,82 dm3 standard állapotú gázt fejleszt. Az előző mintával azonos tömegű cink-aluminium porkeverék híg sósavból 10,878 dm3 standard állapotú gázt fejleszt. A két mintában a cink tömege azonos volt. Hány gramm volt a minták tömege, és egy mintában hány gramm cink volt? MZn=65,4 g/mol MMg=24,3 g/mol MAl=27 g/mol