Egyensúlyok, pH – OKTV feladatok
Vissza az egyensúly, pH témakörre!
6/o-1 (2015/1/12/5)
Ecetsav, monoklór-ecetsav és diklór-ecetsav azonos anyagmennyiség-koncentrációjú vizes oldatát készítjük el. Ezután mindegyik oldatban meghatározzuk a gyenge sav disszociációfokát (a fenti sorrendben 2,90%; 39,9%; 99,1%) és a diklór-ecetsav-oldat pH-ját, ami 1,82-nek adódott.
a) Mennyi a savoldatok koncentrációja?
b) A mérések alapján mennyi az egyes savak savi disszociációs állandója?
6/o-2 (2016/1/12/9)
A HA szerves vegyület sokáig kedvelt reagens volt a klasszikus szerkezetvizsgálatban. Ez az egyértékű sav vízben oldódik. Telített oldatához 0,506 g HA-t kell oldanunk 100 cm3 vízben. Az oldat pH-ja 2,85. Műszeres analitikai módszerekkel meghatároztuk ebben az oldatban HA és A– arányát, amely 18,2-nek adódott.
a) Számítsa ki a HA vegyület savi disszociációs állandóját!
b) Számítsa ki HA moláris tömegét!
6/o-3 (2006/2/2/3)
Van egy 0,0100 mol/dm3 koncentrációjú trifluor-ecetsav- és egy 0,0100 mol/dm3 koncentrációjú ecetsavoldatunk.
a) Adja meg a két oldat pH-ját!
b) Milyen arányban kell összeönteni a két oldatot, hogy a keletkezett oldat pH-ja a két eredeti oldat pH-jának pont a számtani közepe legyen? Ks(ecetsav) = 1,86 . 10–5
6/o-4 (2006/2/2/5)
a) Mekkora annak a savnak a savi disszociációs állandója, amely oldatának közömbösítéséhez 1,10-szer akkora tömegű szilárd NaOH szükséges, mint semlegesítéséhez?
b) Hányszoros mennyiségű szilárd NaOH szükséges egy ecetsavoldat közömbösítéséhez, mint semlegesítéséhez? Ks(ecetsav) = 1,86 ˙ 10–5
(A NaOH adagolása közben a térfogat állandónak tekinthető.)
6/o-5 (2007/2/2/3)
Egy ismeretlen, egyértékű karbonsav 3,00 grammját 1,00 dm3 vízben oldják. A kapott oldat sűrűsége 1,00 g/cm3 maradt.
Az oldat fagyáspont-csökkenéséből meg lehetett állapítani, hogy 37,6 mmol volt az oldatban az oldott ionok és molekulák teljes anyagmennyisége.
Az oldat vezetőképességének vizsgálata pedig arra mutatott, hogy a savmolekulák 18,5 %-a disszociált az oldatban.
A vegyület elégetésekor keletkező égéstermékeket salétromsavval megsavanyított ezüstnitrát- oldatba vezetve fehér csapadék vált le.
Mi volt a sav disszociációállandója és moláris tömege? Melyik savról lehet szó?
6/o-6 (2008/2/2/8)
Egy hallgató azt a feladatot kapta, hogy analitikai tisztaságú borkősavból készítsen pontosan 2,00 pH-jú oldatot. A vegyszerek között talált is egy felbontatlan üvegben vízmentes borkősavat.
Kézikönyvben utánanézett a borkősav savállandóinak, és ezt találta:
| T (oC) | K1 | K2 | |
| L-(+)-borkősav | 25 | 1,05 · 10–3 | 4,57 · 10–5 |
Ennek alapján kiszámolta, hogy 1,000 dm3 oldat elkészítéséhez hány gramm borkősavra van szükség, azt nagy pontossággal bemérte, desztillált vízben feloldotta, majd az oldatot felhígította 1,000 dm3-re.
Az elkészült oldatból kimért 100,0 cm3-t és megmérte a pH-ját. Meglepődve tapasztalta, hogy a pH néhány százalékkal eltér a kívánt 2,00 értéktől, amit különösen furcsállott, tekintettel az oldatkészítés pontosságára. A 100,0 cm3 oldatban még 1,066 g borkősavat fel kellett oldania ahhoz – elhanyagolható térfogatváltozás mellett –, hogy a pH pontosan 2,00 legyen.
Ezzel elkészült ugyan a kért oldat, de a hallgatót nem hagyta nyugodni a kiszámolt és a szükséges borkősavmennyiség közötti eltérés problémája. Ellenőrizte számításait: azok kétséget kizáróan helyesnek és pontosnak bizonyultak. Ezután a felhasznált borkősav szennyezettségére gondolt. A laboráns említette neki, hogy a borkősavban néha előfordulhat oxálsav szennyezés. Ezt a lehetőséget azonban rövid számolás után elvetette, egyébként pedig a felhasznált anyag – a doboz felirata szerint – igen nagy tisztaságú volt.
Hamarosan azonban eszébe jutott valami. Egy kis számolgatás után elővett egy részletes analitikai kézikönyvet, majd alaposabban megvizsgálta a felhasznált borkősav dobozát is.
Örömmel nyugtázta, hogy végre megoldotta a „rejtélyt”, és még a feladatot is maradéktalanul teljesítette.
a) Hány gramm borkősavat mért be az 1,000 dm3 oldat elkészítéséhez?
b) Ésszerű közelítéseket alkalmazva számítsa ki, hogy mennyivel tért el az eredetileg elkészített oldat pH-ja a kívánt 2,00 értéktől!
c) Miért zárható ki, hogy oxálsav szennyezés okozta a pH-eltérést?
d) Vajon milyen adatot ellenőrzött a hallgató a kézikönyvben, és mit talált a doboz címkéjén, amely végül elvezette a megoldáshoz?
M(borkősav) = 150,09 g/mol; K1(oxálsav) = 5,89·10–2; K2(oxálsav) = 6,46·10–5
6/o-7 (2009/2/2/1)
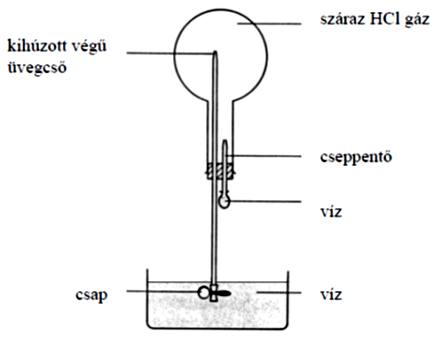 A sósav-szökőkút kísérletet az ábrán mutatott berendezésben végzik. 1 dm3 térfogatú lombikot megtöltenek HCl-gázzal. A cseppentőből egy csepp vizet juttatnak a lombikba. A lombik alapos összerázása után kinyitják a csapot. A lombikba a víz szőkőkútszerűen felspriccel.
A sósav-szökőkút kísérletet az ábrán mutatott berendezésben végzik. 1 dm3 térfogatú lombikot megtöltenek HCl-gázzal. A cseppentőből egy csepp vizet juttatnak a lombikba. A lombik alapos összerázása után kinyitják a csapot. A lombikba a víz szőkőkútszerűen felspriccel.
Becsülje meg, hogy a kísérlet végén milyen pH-jú oldat lesz a lombikban!
6/o-8 (2009/2/2/7)
Mennyi a következő oldatok pH-ja?
a) 0,02 mol/dm3-es sósav
b) 0,02 mol/dm3-es kénsav K2(kénsav) = 0,012
c) a fenti két oldat 1:1 arányú elegye
6/o-9 (2010/2/2/6)
Mekkora térfogatú 25 oC-os, standard nyomású ammóniát kell elnyeletni 1,00 dm3 2,00 pH-jú kénsavoldatban, hogy a pH-ja 1,00 egységgel változzon? (Az oldódás során bekövetkező térfogatváltozás elhanyagolható.)
Ks2(H2SO4) = 1,20 · 10–2; Kb(NH3) = 1,78 · 10–5
6/o-10 (2011/2/2/8)
Ecetsav és hangyasav azonos koncentrációjú vizes oldatát 5,00 : 1,00 térfogatarányban összekeverve 3,00 pH-jú oldatot kapunk.
a) Mekkora volt az eredeti oldatok koncentrációja?
b) Mekkora lesz a pH, ha az oldatokat 1,00 : 5,00 térfogatarányban elegyítjük? (A számítás során tehet ésszerű elhanyagolásokat, ha igazolja ezek jogosságát.)
Ks(ecetsav) = 1,75 · 10–5; Ks(hangyasav) = 1,77 · 10–4
6/o-11 (2012/2/2/8)
A 3,4-dinitro-benzoesav telített oldatának összetétele 20° C-on 0,67 g sav / 100 cm3 víz. A telített oldat pH-ja 2,21.
a) Mennyi a sav disszociációs állandója?
b) Hány gramm szilárd NaOH-t kell a 100 cm3 vízben oldani, hogy a savból 20 °C-on pontosan kétszer annyi oldódjon, mint a tiszta vízben?
Az oldódás során bekövetkező térfogatváltozást minden esetben elhanyagolhatjuk.
6/o-12 (2013/2/2/5)
Egy egyértékű savat (jelölje HA) 0,10 mol/dm3 koncentrációban tartalmazó vizes oldatban meghatározták bizonyos molekulák, illetve ionok (specieszek) egyensúlyi koncentrációját, miközben az oldat pH-ját – gyakorlatilag állandó térfogaton – egy szilárd anyag hozzáadásával változtatták. Az alábbi diagram mutatja néhány koncentráció logaritmusának pH-függését.
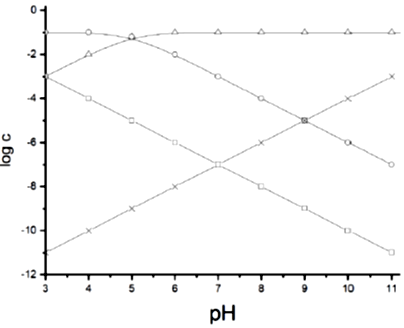
a) Milyen specieszek (azaz molekulák vagy ionok) koncentrációját mutatja a négy görbe (x, o, □, Δ)?
b) Mi lehet az a speciesz, aminek az ábrázoltakon felül is jelen kell még lennie az oldatban pH = 7-nél?
c) Mennyi a HA gyenge sav disszociációállandója?
d) Mennyi lesz a [HA]+[A–] mennyiség értéke 12-es pH-n?
e) A kiindulási sav tiszta (0,10 mol/dm3 koncentrációjú) oldatát ezerszeresére hígítva mi lesz a kapott oldat pH-ja
6/o-13 (2013/2/2/7)
Ismeretlen koncentrációjú nátrium-hidrogén-szulfát-oldatot vizsgálunk. Ha az oldatot tízszeres térfogatúra hígítjuk, vezetőképesség-méréssel kideríthető, hogy a hidrogén-szulfát-ionok disszociációfoka az eredeti 1,683-szorosa lesz.
a) Mekkora volt a hidrogén-szulfát-ionok disszociációfoka a kiindulási oldatban?
A kiindulási oldatba merített pH-mérő 1,72-es értéket mutatott.
b) Mekkora volt a mérések alapján a kiindulási oldat koncentrációja?
c) A mérések alapján mekkorának adódik a kénsav második savi disszociációs állandója?
6/o-14 (2014/2/2/6)
Dr. Ezésez Géza vízköves forralóját kívánta megtisztítani. Minthogy irodájában nem akadt háztartási ecet, a munkavédelmi szabályokat súlyosan megsértve a laborjában analitikailag tiszta ecetsav (jégecet) néhány cseppjét öntötte a bögréjében levő fél liter vízhez. Ezt az oldatot a forralóba akarta önteni, de egy hirtelen ötlet hatására előbb visszaszaladt a laborba és újabb szabálytalanságként egy tápoldatot ellenőrző pH-mérőt merített bele a bögrébe.
Azt a pár percet, amíg az ecet hat, az e-mailjei ellenőrzésével akarta tölteni, de miután órák múlva felállt a számítógépe mellől, a forraló már ragyogóan tiszta volt. Diákjai rosszalló tekintete előtt most a laborban a pH-mérőt magába a forralóba merítette bele. Két pH-értéket – 3,95 és 4,67 – dünnyögve ment vissza a szobájába és pár perc múlva elégedetten újságolta mindenkinek a közelben, hogy hány milligramm vízkövet termelt az évben. Persze az segítette a számolásban, hogy unalmas kémiapéldák sokasága a memóriájába égette az ecetsav Ks értékét (1,75·10−5).
Milyen értéket kellett kapnia Ezésez doktornak, ha úgy tekintette, hogy a vízkő tisztán mészkőből áll?
6/o-15 (2015/2/2/4)
Az indikátorok olyan vegyületek, amik maguk is gyenge savak (vagy bázisok), és a disszociáció során egymásba alakuló két forma eltérő (és élénk) színű. Az oldat színét (a szín árnyalatát) a két forma koncentrációjának aránya határozza meg. Ha a savas közegre jellemző forma koncentrációja legalább tízszerese a bázikus alakénak, akkor az indikátor a savas közegre jellemző színt mutatja. Fordítva, ha a bázisos közegre jellemző forma koncentrációja haladja meg minimum tízszeresen a savas közegre jellemző forma koncentrációját, akkor az indikátor bázisos közegre jellemző színét látjuk.
Ha az arány a két érték között van, akkor az indikátor átmeneti színe jelenik meg.
(Mivel a látás a különböző színekre eltérően érzékeny, az 1:10-es arány nem minden indikátor esetén jellemző, azaz az átcsapási tartomány sem egyformán széles. De ettől most el fogunk tekinteni.)
A fenolvörös indikátor savas közegben sárga, lúgos közegben vörös színű. Átcsapását az alábbi reakcióegyenlet mutatja:
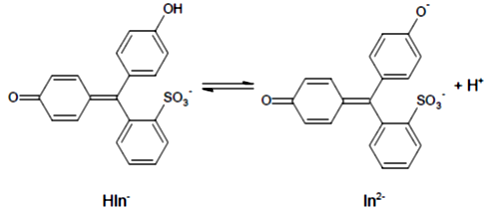
a) A két forma közül melyik felel a savas közegben látható sárga színért? Használja az ábrán látható HIn–, illetve In2– jelöléseket!
1 liter ismert pH-jú oldathoz 2 csepp fenolvörösoldatot cseppentünk.
b) Fejezze ki a fenti reakció egyensúlyi állandója (K) és a pH értéke segítségével, hogy egy adott pH-értéken mennyi a két forma koncentrációjának aránya ([HIn–]/[In2–])!
c) Milyen pH értékek között látjuk a fenolvörös átmeneti, narancssárga színét?
K = 2,5·10–8
6/o-16 (2015/2/2/7)
Az alábbi oldatok állnak rendelkezésünkre: 0,100 mol/dm3 koncentrációjú kénsavoldat, 0,100 mol/dm3 koncentrációjú ecetsavoldat, 0,100 mol/dm3 koncentrációjú nátrium-hidroxid oldat.
a) Mekkora az egyes oldatok pH-ja?
b) Az oldatok páronkénti összeöntésével mely esetekben kaphatunk 3,00-as pH-jú oldatot? Mekkora térfogatarányban kell ekkor az oldatokat összeönteni? (Az oldatok összeöntése során bekövetkező térfogatváltozást tekintsük elhanyagolhatónak!)
Ks2(H2SO4) = 1,90 ∙ 10–2, Ks(CH3COOH) = 1,86 ∙ 10–5
6/o-17 (2016/2/2/4)
A Fehling-II-oldatot az alábbi recept alapján készíthetjük el: 17,3 g kálium-nátrium-tartarátot és 7,0 g nátrium-hidroxidot oldjunk fel vízben, és az oldat térfogatát 70 cm3-re egészítsük ki.
A tartarátion a borkősav savmaradékionja. A borkősav savi disszociációs állandói:
K1 = 9,2∙10–4, K2 = 4,3∙10–5
A kapott oldatot egy kísérlethez százszoros térfogatra hígítják desztillált vízzel.
a) Határozza meg a hígított Fehling-II-oldat pH-ját!
Egy figyelmetlen laboráns kálium-nátrium-tartarát helyett véletlenül kálium-hidrogén-tartarátot használt az oldat készítéséhez (de egyébként követte a recept utasításait).
b) A hibásan készített oldatot is felhígították százszoros térfogatúra. Mennyi lett ennek az oldatnak a pH-ja?