Gáztörvények
Halmazállapotok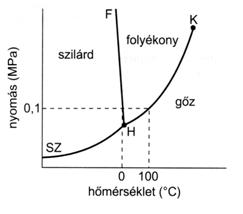
- Szilárd: kristályos, amorf
- Fluidum: folyadék, gáz
- (Plazma)
Halmazállapot változások
- Fagyás – Olvadás
- Szublimáció – Deszublimáció
- Párolgás – Kondenzáció
Tökéletes gázok
- Pontszerű
- Nincs kiterjedésük
- Tökéletesen rugalmasan ütköznek
- Teljesülnek rájuk a tökéletes gázok törvényei
Reális gázok
- Nem pontszerűek
- Van kiterjedésük
- Nem tökéletesen rugalmasan ütköznek
- Teljesülnek rájuk a reagális gázok törvényei
Avogadro törvény:
Mivel az ideális gázok között a részecskék kölcsönhatása elhanyagolható, ezért az azonos térfogatú, azonos hőmérsékletű és azonos nyomású gázok azonos számú részecskét tartalmaznak.
Másképp megfogalmazva: Azonos hőmérsékleten és nyomáson a gázok térfogata az anyagmennyiségükkel arányos. Tehát bármely tökéletes gáz 1 molnyi molekulája azonos nyomáson megegyező térfogatot tölt ki.
Relatív sűrűség:
![]()
Gázok állapothatározói

| P | T | |
|
Standard állapot |
101,325 kPa | 298,15 K (= 25 °C) |
|
Normál állapot |
101,325 kPa |
273,15 K (= 0 °C) |
A parciális nyomás
- A parciális nyomás az a nyomás a mit a vizsgált gáz fejtene ki akkor, ha önmagában töltené ki az egész rendelkezésre álló teret.
- Jele: 𝑃𝑖
Dalton-törvény
- A parciális nyomások összege megadja az össznyomást.
- ∑𝑖 𝑃𝑖 = 𝑃
A parciális térfogat
- A parciális térfogat az a térfogat, amit a gáz az adott nyomáson kitöltene.
- Jele: 𝑉𝑖
Amagat-szabály
- A parciális nyomások összege megadja az össznyomást.
- ∑𝑖 𝑉𝑖 = 𝑉
A tenzió fogalma
- A tenzió az a parciális gőznyomás, ami egyensúlyt tart a folyadék fázissal az adott hőmérsékleten.
Mikor is forr fel valami?
- Akkor beszélünk forrásról ha a tenzió eléri a külső nyomást.
Mi a különbség a párolgás és a forrás között?
- Párolgás során csak a folyadék-gőz határon történik az átalakulás.
- Forrás során már a folyadékfázison belül is van átalakulás.
Miért jó ez nekünk?
- Magasabb nyomáson, magasabb hőmérsékleten forrnak el az anyagok.
Gázok folyamatai
|
Izobár |
Izochor/Izosztér |
Izoterm |
| ΔP = 0 | ΔV = 0 | ΔT = 0 |
|
Gay-Lussac I. |
Gay-Lussac II. |
Boyle-Mariotte |
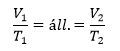 |
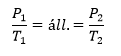 |
Az egyesített gáztörvény
- Az előző három törvény egyesítéséből kapjuk
Az univerzális gáztörvény
- az egyesített gáztörvényből és az Avogadro-törvényből jön ki:
- P: A gáz nyomása [Pa] / [kPa]
- V: A gáz térfogata [m³] / [dm³]
- n: A gáz mólszáma [mol]
- R: Regnault állandó = 8,314 [J/(mol*K)]
- T: A gáz hőmérséklete [K]