Egyensúlyok, pH – Elméleti összefoglaló
Egyensúlyi reakciók
A megfordítható kémiai reakciók esetén a kiindulási anyagokból képződő termékek visszaalakulnak a kiindulási anyagokká. Elvileg minden kémiai reakció megfordítható. Mikor az oda-vissza alakulás sebessége egyenlővé válik, úgynevezett dinamikus egyensúly alakul ki.
Az egyensúlyi állapotot jellemzi az egyensúlyi állandó, mely adott hőmérsékleten jellemző egy reakcióra. Az egyensúly törvénye (tömeghatás törvénye) szerint a termékek egyensúlyi koncentrációjának megfelelő hatványon vett szorzatából és a kiindulási anyagok egyensúlyi koncentrációjának megfelelő hatványon vett szorzatából képzett tört értéke adott hőmérsékleten állandó.
Például a N2 (g) + 3 H2 (g) ↔ 2 NH3 (g) folyamat eseten az egyensúlyi állandó: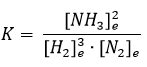 ahol a
ahol a ![]() , és a
, és a![]() az egyensúlyi koncentrációk.
az egyensúlyi koncentrációk.
Az egyensúlyi állapot megzavarható. Ezt a Le Chatelier-elv alapján becsülhetjük meg.
Le Chatelier-elv (a legkisebb kényszer elve):
Ha egy egyensúlyi rendszert külső hatás ér, akkor abban az a folyamat erősödik fel, amelyik ezt a hatást kompenzálni igyekszik.
- A koncentráció változtatásának hatása:
A kiindulási anyagok koncentrációjának növelése vagy a termékek elvezetése az egyensúlynak az átalakulás irányába va1ó eltolódását hozza létre. A kiindulási anyagok koncentrációjának csökkentése és, vagy a termékek koncentrációjának növelése a visszaalakulás irányába tolja el az egyensúlyt. - A hőmérséklet-változás hatása
A Le Chatelier-elv alapján a hőmérséklet emelése az endoterm, a hőmérséklet csökkentése az exoterm irányba tolja el az egyensúlyt. A hőmérséklet változtatásakor megváltozik az egyensúlyi állandó, mivel a hőmérséklet nem egyforma mértékben változtatja meg az oda- és visszaalakulás reakciósebességet (azaz a reakciósebességi állandókat). - A nyomásváltoztatás hatása:
A nyomás csak akkor befolyásolja az egyensúlyi állapotot, ha a folyamat mólszám-változással jár. A nyomás növelése a Le Chatelier-elv értelmében a mólszám csökkenése irányába tolja el az egyensúlyt. (A kisebb mólszám kisebb nyomást jelent. A rendszer csökkenteni igyekszik a nyomást.) - A katalizátor hatása az egyensúlyra:
A katalizátor mindkét irányban csökkenti az aktiválási energiát, ezért az egyensúly gyorsabban alakul ki, de az egyensúlyi koncentrációviszonyokat a katalizátorok nem befolyásolják.
Sav-bázis reakciók
- Arrhenius szerint: a savak olyan anyagok, amelyek hidrogénionra (és anionra), a bázisok olyan anyagok, amelyek hidroxidionra (és kationra) disszociálnak (vizes oldatban).
- Bronsted szerint: a savak protonleadásra, a bázisok protonfelvételre képes anyagok.
A Bronsted-féle sav-bázis fogalom magába foglalja az arrheniusi savakat és bázisokat, de annál szélesebb körben értelmezi a sav-bázis fogalmat.
Értelmezhető:
– nemcsak vegyületek, hanem ionok is rendelkeznek sav-bázis tulajdonsággal,
– nemcsak vizes oldatban értelmezhetők a sav-bázis reakciók [pl. az NH3(g) + HCl(g) = NH4Cl(sz) folyamat is annak tekinthető].
A továbbiakban elsősorban Bronsted elmélete szerint értelmezzük a sav-bázis reakciókat.
Sav-bázis párok:
– A sav-bázis fogalom relatív. Egy anyagot csak akkor nevezhetünk savnak vagy bázisnak, ha ismerjük a partnereit. (A leszakadó protonok szabadon nem léteznek, tehát csak akkor viselkedhet savként egy anyag, ha van egy másik, amely képes megkötni a pozitív töltésű protont.)
– Egy reakcióban savként viselkedő anyag (pl. HCl) olyan részecskévé (Cl–) alakul, amelyik a mellette feltüntetett reakciópartnerek (H3O+) protonját képes felvenni, vagyis bázis lesz (ezért „konjugált bázis”-nak nevezik). Ez fordítva is igaz, vagyis egy bázisból a reakció során sav keletkezik (konjugált sav):
HCl + H2O ↔ Cl– + H3O+
sav1 bázis2 bázis1 sav2
Bronsted elmélete szerint a sav-bázis fogalom egy adott reakcióban betöltött szerepre vonatkozik. (Egy adott vegyület viselkedhet savként és bázisként is a reakciópartnertől függően.)
A protolitikus reakciók is egyensúlyi reakciók. Erős savaknak azokat a vegyületeket nevezhetjük, amelyek híg vizes oldatban gyakorlatilag teljesen disszociálnak, vagyis egyensúlyi állandójuk értéke nagy. pl.: HCl, HBr, HI, H2SO4, HNO3, HClO4 stb.
A gyenge savak híg vizes oldatban sem disszociálnak teljesen. A disszocióciófok a hígítással még híg (c < 0,l mol/dm3) oldatok esetén is nagymértékben nő. Pl.: H2S, H2SO3, HNO2, HClO2, HOCl, H2CO3) és a legtöbb szerves sav (HCOOH, CH3COOH, a fenol stb.).
A saverősséget a savállandóval adhatjuk meg. Egy HA összképletű savra ez:![]()
Minél kisebb a Ks értéke, annál gyengébb savról van szó.
Erős bázisokat gyakorlatilag csak az ionvegyületek között találunk. Ilyenek az alkálifém-hidroxidok (pl. NaOH, KOH) és a legtöbb alkáliföldfém-hidroxid (kálcium-, stroncium- és bárium-hidroxid), melyek vízben jó1 oldódnak, az oldódás során teljesen disszociálnak:
NaOH (sz) = Na+ (aq) + OH– (aq)
Gyenge bázisok: egyrészt azok az anyagok, amelyek molekulái közül még híg vizes oldatban sem protonálódik az összes. Például: NH3 + H2O = NH4+ + OH–
A bázisállandó: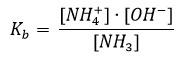
Ilyen gyenge bázisok a szerves vegyületek közé tartozó aminok is.
A bázisokra is igaz, hogy minél gyengébb bázisról van szó, annál kisebb a bázisállandó értéke. Továbbá gyenge bázisnak tekinthetők a vízben rosszul oldódó, rosszul disszociáló hidroxidok is.
Pl. Mg(OH)2, Fe(OH)3 stb., gyakorlatilag az összes p- és d-mezőbeli fém-hidroxid.
A víz autoprotolízisből( H2O + H2O ↔ H3O + OH–) következően a tiszta víz is tartalmaz oxónium- és hidroxidionokat. Például 25 oC -on: [H3O+] = [OH–] = 10-7 mol/dm3.
Ezek koncentrációját az oldatba bevitt savak és bázisok megváltoztatják. A bevitt sav növeli az oxóniumion-koncentrációt, ezáltal csökkenti a víz autoprotolízisből származó ionokat (Kv = [H3O+] .[OH–] ugyanis állandó), és így csökkenti a kizárólag a vízből származó hidroxidion-koncentrációt. A bevitt bázis növeli a hidroxidion-koncentrációt és lúgos kémhatást okoz. (Csökkenti a víz autoprotolízisét, és ezzel visszaszorítja az oxóniumionok koncentrációját.)
A 25 oC-on fennálló összefüggések: Kv = [H3O+] . [OH–] = 1 . 10-14,
semleges kémhatású oldatban: [H3O+] = [OH–] = 10-7 mol/dm3,
savas kémhatású oldatban: [H3O+] > [OH–], így [H3O+] > 10-7 mol/dm3,
lúgos kémhatású oldatban: [H3O+] < [OH–], igy [H3O+ ] < 10-7 mol/dm3.
A kémhatás egyszerűbb kifejezésére vezették be a pH fogalmát, amely az oldat oxóniumion-koncentrációjának negatív, tízes alapú logaritmusa: pH = – lg[H3O+]
Bár minden oldat kémhatását a pH-val szokás jellemezni, a lúgoldatokból előbb célszerű a pOH-t meghatározni, és abból pKv segítségével a pH-t megadni: pKv = pH + pOH = – lg10-14 = 14
Így a különböző kémhatású oldatok pH-ja 25 oC-on:
– semleges oldat: pH = 7,
– savas oldat: pH < 7,
– lúgos oldat: pH > 7.
Sók hidrolízise: olyan kémiai reakció, amelyben valamilyen só anionja vagy kationja lép protolitikus reakcióba a vízmolekulákkal.
Ha egy erős sav (pl. HCl) a vízzel reakcióba lép, a belőle képződő bázis (Cl–) a mellette feltüntetett savval (H3O+) szemben igen gyenge bázisként viselkedik:
HCl + H2O = Cl– + H3O+
erős s1 b2 gyenge b1 s2
Ebből az is következik, hogy egy, a vízhez képest gyenge savbó1 származó anion az oxóniumionokkal szemben erős bázisként viselkedik:
CH3COOH + H2O ↔ CH3COO– + H3O+
gyenge s1 b2 erős b1 s2
Ha egy vizes oldatba az erős savból, illetve a gyenge savból származó ion kerül (pl. a sav nátriumsója, pl. NaCl, CH3COONa), akkor ezek közül csak a gyenge savból származó anionról feltételezhető, hogy az oxóniumionokhoz képest jóval gyengébb savként viselkedő vízmolekulákkal szemben számottevő bázicitást mutat: CH3COO– + H2O ↔ CH3COOH + OH– folyamat egyensúlyi állandója tulajdonképpen a gyenge savból származó anionra vonatkoztatott bázisállandó, amit hidrolízisállandónak is nevezhetünk:![]()
A gyenge savból származó iont tartalmazó, vízben oldódó só esetében az anion lúgosan hidrolizál.
Hasonló gondolatmenettel bizonyítható az is, hogy a gyenge bázisból származó iont tartalmazó só esetében a kation savasan hidrolizál: például az ammónium-klorid, vagy az ammónium-nitrát vizes oldatában az NH4+ + H2O ↔ NH3 + H3O+ folyamat megy végbe.
(A fenti összefoglalás Villanyi Attila: Kémia – Összefoglaló középiskolásoknak című műve felhasználásával készült.)
A számítás menete
Az egyensúlyi feladatok megoldásánál nagyon fontos az alábbi táblázat elkészítése:
A + B ↔ C +D
Kiindulási állapot: 1 1 0 0
Átalakulás -x -x x x
Egyensúly 1-x 1-x x x
A fenti feladatban sztöchiometrikus arányú kiindulási keverékből indulunk. Indulásnál a termékek köncentrációja nulla. Az átalakulás során ismeretlen (x) mennyiségű termék alakul át, az sztöchiometriai arányoknak megfelelően mind az A mind a B anyag esetében. Szintén ezen okból mind C mind a D termékből egyenlő mennyiség keletkezik, amely megegyezik az elreagált anyag mennyiségével. Ebből következően az alsó sor mutatja az egyensúlyban megtalálható koncentrációkat. A táblázatban célszerű rögtön koncentráció egységeket szerepeltetni, mert ez esetben az egyensúlyi állandó azonnal felírható.![]() A táblázatot lehet mólszámokkal is kitölteni, ez esetben azonban nagyon kell vigyázni az egyensúlyi állandó felírásnál, hiszen abban koncentrációk szerepelnek. (Ha a reakció nem jár mólszám-változással, akkor a hatványkitevők egyezősége miatt az egyensúlyi állandó mólszámokkal is felírható. (Azonos a térfogat, amivel lehet egyszerűsíteni.))
A táblázatot lehet mólszámokkal is kitölteni, ez esetben azonban nagyon kell vigyázni az egyensúlyi állandó felírásnál, hiszen abban koncentrációk szerepelnek. (Ha a reakció nem jár mólszám-változással, akkor a hatványkitevők egyezősége miatt az egyensúlyi állandó mólszámokkal is felírható. (Azonos a térfogat, amivel lehet egyszerűsíteni.))
Ammónia szintézis esetében a táblázat a következőképpen néz ki, ha 1:2 mólarányú nitrogén-hidrogén gázkeverékből indulunk ki és a térfogat 1 dm3.
N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Kiindulási állapot: 1 2 0
Átalakulás -x -3x 2x
Egyensúly 1-x 2-3x 2x
A kiindulási koncentrációk 1 illetve 2 mol/dm3, az ammónia kezdeti koncentrációja nulla. Ha feltételezzük, hogy a nitrogénből x mennyiség alakul át, akkor a sztöchiometria miatt a hidrogénből háromszor ennyi (3x) szükséges és mindeközben kétszerannyi ammónia (2x) keletkezik. Az egyensúlyba a két fenti sor ősszege kerül.
Ez alapján az egyensúlyi állandó értéke:![]()
Az egyes feladatok során x kiszámítására több módszer is szóba jöhet, ahogy a feladat ezt meghatározza. Például a fenti általános példában, ha ismerjük a K értékét x egy másodfokú egyenlet megoldásával meghatározható. Az ammónia szintézis esetében ez így jóval bonyolultabb lenne (negyedfokú egyenlet), ezért nagy valószínűséggel a feladatban x egyszerűbb módszerekkel meghatározható, majd ez után például az egyensúlyi állandó kiszámítható.
Híg oldatokban lejátszódó egyensúlyi reakciók (pH számítás)
- Erős savak és bázisok pH-ja:
Az erős savak és bázisok vizes oldatban teljesen disszociálnak. Azaz egy 0,1 mol/dm3 koncentrációjú sósav oldatban a teljes disszociáció miatt 0,1 mol/dm3 a H+ ion koncentráció. Ebből következően a pH=1. Hasonlóan egy 0,01 mol/dm3 koncentrációjú NaOH oldatban az OH– ion koncentráció 0,01 mol/dm3. Így a pOH=2, a pH=12. - Gyenge savak és bázisok pH-ja.
A gyenge savak és bázisok disszociációja nem teljes, azaz egyensúlyra vezet. Így egy c koncentrációjú gyenge sav pH-ját a következőképen lehet kiszámítani:
HA ↔ H+ + A–
Kiindulási állapot: c 0 0
Átalakulás -x x x
Egyensúly c-x x x
Behelyettesítve az egyensúlyi állandóba: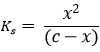
A másodfokú egyenletet megoldva x meghatározható.
A keresett pH = – lg [H+] = – lg x.
A gyenge sav disszociációfokát az átalakult mólok arányában fejezhetjük ki.
α = átalakult mólok száma / kiindulási mólok száma = x / c.
Gyenge bázisok esetében a megoldás menete a következő:
legyen a gyenge bázis koncentrációja q.
BOH ↔ B+ + OH–
Kiindulási állapot: q 0 0
Átalakulás -x x x
Egyensúly q-x x x
Behelyettesítve az egyensúlyi állandóba: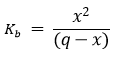
A másodfokú egyenletet megoldva x meghatározható.
Innen a pOH = – lg [OH–] = – lg x , pH = 14 – pOH.
- Gyenge sav (gyenge bázis) disszociációja erős sav (erős bázis) jelenlétében. (Az egyensúly eltolása.)
Amennyiben a gyenge sav mellett erős sav is jelen van, akkor a gyenge sav disszociációja visszaszorul, viszont az erős sav miatt a pH csökken.
A számítás menete ilyenkor a következő: legyen a gyenge sav koncentrációja c, az erős sav koncentrációja y.
HA ↔ H+ + A–
Kiindulási állapot: c y 0
Átalakulás -x x x
Egyensúly c-x x+y x
Behelyettesítve az egyensúlyi állandóba: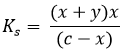
A másodfokú egyenletet megoldva x meghatározható.
A keresett pH = – lg [H+] = – lg (x+y).
A disszociációfok viszont ebben az esetben kisebb lesz, mint erős sav nélkül. (A disszociáció visszaszorul, az egyensúly a kiindulási anyagok irányába tolódik el.)
Gyenge bázisok esetén a számítás hasonló: legyen q a gyenge bázis és u az erős bázis koncentrációja
BOH ↔ B+ + OH–
Kiindulási állapot: q 0 u
Átalakulás -x x x
Egyensúly q-x x x+u
Behelyettesítve az egyensúlyi állandóba:![]()
A másodfokú egyenletet megoldva x meghatározható
Innen a pOH = – lg [OH–] = – lg (x+u) , pH = 14 – pOH.
- Gyenge sav (bázis) sójának viselkedése (hidrolízis).
Ha egy gyenge sav erős bázissal képzett sóját (pl nátrium-acetát) vizes oldatba tesszük, akkor a gyenge sav savmaradéka reakcióba lép a vízzel miközben hidroxid ionok keletkeznek. Ebben az esetben a hidrolízis egyensúlyi állandóját a Ks savi disszociációállandó segítségével a következőképpen számíthatjuk ki. Legyen a só koncentrációja v.
A– + H2O ↔ HA + OH–
Kiindulási állapot: v 0 0
Átalakulás -x x x
Egyensúly v-x x x
Az egyensúlyi állandó levezetése:![]()
![]()
A másodfokú egyenletet megoldva x meghatározható.
Ebben az esetben x az OH– ion koncentrációját jelöli, így pOH = – lg [OH–] = – lg x, és pH = 14 – pOH.
Amennyiben v és x között minimum három nagyságrend eltérés van akkor a fenti számítás egyszerűsíthető:![]()
Bázisok esetén értelemszerűen: ![]() (ha lehet elhanyagolni), ahol w a bázis sójának koncentrációja és ebben az esetben x a H+ koncentrációt jelöli, azaz pH = -lg x.
(ha lehet elhanyagolni), ahol w a bázis sójának koncentrációja és ebben az esetben x a H+ koncentrációt jelöli, azaz pH = -lg x.
- Gyenge sav és gyenge sav sójának (gyenge bázis és gyenge bázis sójának) közös oldata (puffer oldat)
Ha egy gyenge sav erős bázissal képzett sójával közös oldatban található, akkor a fent leírt jelenségek (gyenge sav disszociációja és a gyenge sav sójának hidrolízise) egymás mellett játszódnak le, és egymásra is hatással lesznek. Ebben az esetben – itt nem részletezendő – levezetések után az oldat pH-ját a következőképpen számíthatjuk ki:![]() , illetve a pH = – lg [H+].
, illetve a pH = – lg [H+].
Ebben az esetben azért lehet mólszámokat is alkalmazni a hányadosban, mert közös oldatban vannak, azaz azonos a térfogatuk, amivel lehet egyszerűsíteni (c = n / V).
Bázisok esetében:
![]() , illetve pOH = – lg [OH–], pH = 14 – pOH
, illetve pOH = – lg [OH–], pH = 14 – pOH
Nagyon fontos megjegyezni, hogy a fenti esetekben nagyon sokszor oldatok összeöntésével kapjuk meg a számítandó oldatunkat. Ezért minden esetben újra kell számolni az anyagok koncentrációját. Kérem, erről sose feledkezzünk meg!