Termokémia – Elméleti összefoglaló
Halmazállapotok: 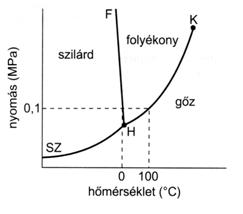
- Szilárd: kristályos, amorf
- Fluidum: folyadék, gáz
- (Plazma)
Halmazállapot változások:
- Fagyás – Olvadás
- Szublimáció – Deszublimáció
- Párolgás – Kondenzáció
Termokémiai egyenlet
Mivel a vegyületek által tárolt kémiai energia mennyisége eltérő a különböző halmazállapotokban, ezért a termokémiai egyenletben nem elég feltüntetni a megfelelő reaktánsokat és termékeket, hanem rögzíteni kell azok halmazállapotát is.
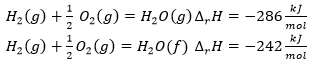
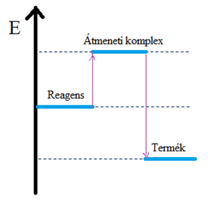
Reakciót kísérő energiaváltozások
|
A reakcióhő |
|
|
|
|
|
A képződéshő |
|
|
|
|
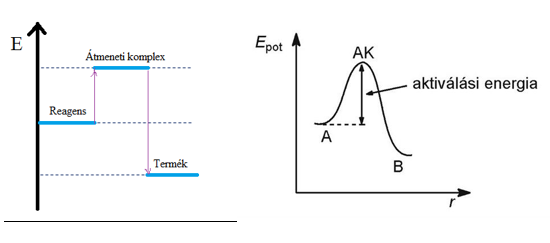
Hess tétel
- A reakcióhő csak a kiindulási és a végállapottól függ.
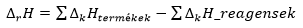
- A reakcióhő NEM függ a reakcióúttól
Hess tételének a következménye körfolyamatokra
- Körfolyamatokra a reakcióhők összege nulla
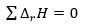
- Így kiszámíthatóak olyan reakciókat kísérő energiaváltozások melyeket a valóságban nehezen, vagy egyáltalán nem áll módunkban megvalósítani