Termokémia – közép szintű érettségi feladatok
Vissza a termokémia témakörre!
4/k-1 (2005. május, 5. feladat B)
Egy 40,0 térfogat% metánt és 60,0 térfogat% propánt tartalmazó gázelegyet tökéletesen elégetünk.
ΔkH(metán(g)) = −74,9 kJ/mol; ΔkH (propán(g)) = −104,0 kJ/mol;
ΔkH (CO2(g)) = −394,0 kJ/mol; ΔkH (H2O(f)) = −286,0 kJ/mol
a) Írja fel a két szénhidrogén tökéletes égésének reakcióegyenletét, és számítsa ki a reakcióhőket! (Az égés során a vízgőz lecsapódik.)
b) Hány kJ hőmennyiség szabadul fel a 25,0 °C-os, standard nyomású gázelegy 1,00 dm3-ének elégetése során?
c) Mekkora volt az 1,00 dm3 kiindulási gázelegy tömege?
4/k-2 (2006. február, 5. feladat)
Az energiaágazatban sokan beszélnek olajválságról. Eközben folynak a kísérletek, mivel lehet a kőolaj-származékokat helyettesíteni. Az egyik lehetőségnek tűnik az alkohol-üzemeltetésű motor. Hasonlítsuk össze a benzin- és alkohol-üzemeltetésű motorok energiatermelését!
Számításaihoz használja a következő adatokat:
ΔkH (oktán) = –372 kJ/mol ρ(oktán) = 0,720 g/cm3
ΔkH (etanol) = –278 kJ/mol ρ(etanol) = 0,790 g/cm3
ΔkH (CO2) = –394 kJ/mol (1,00 liter = 1,00 dm3)
ΔkH(vízgőz) = –242 kJ/mol
a) Írja fel az etanol tökéletes égésének reakcióegyenletét és számítsa ki a reakcióhőt!
b) Tegyük fel, hogy a benzin tisztán oktánból áll. Írja fel az oktán tökéletes égésének egyenletét és számítsa ki a reakcióhőt!
c) Számítsa ki, hogy 1,00 liter benzin elégetésekor felszabaduló hő mekkora térfogatú etanol égésekor keletkezik?
4/k-3 (2006. október, 8. feladat)
A citromsav (C6H8O7) a lekvárok, zselék és gyümölcslevek összetevője, amelyet iparilag cukoroldat (szacharóz) fermentációjával (gombák általi erjesztéssel) a levegő oxigénjét felhasználva állítanak elő az alábbi reakcióegyenlet szerint:
C12H22O11 + 3 O2 = 2 C6H8O7 + 3 H2O
Az oldott állapotú anyagokra vonatkozó képződéshők: ΔkH(H2O(f)) = –286 kJ/mol, ΔkH (szacharóz) = –2226 kJ/mol, ΔkH (citromsav) = –1544 kJ/mol
Ar(H) = 1,00; Ar(C) = 12,0; Ar(O) = 16,0
a) Számítsa ki a folyamat reakcióhőjét!
b) Ha 20,0 kg 65,0 tömeg%-os cukoroldat teljes cukor tartalmát ezzel az eljárással citromsavvá alakítják, akkor elvileg hány tömeg%-os lesz a kapott oldat citromsavra nézve?
c) Számítsa ki, mennyi hő szabadul fel a b) kérdésben szereplő folyamat során?
4/k-4 (2007. május, 5. feladat B)
Az ember szervezetében az energiatermelésnek két lehetősége van: a biológiai oxidáció és a tejsavas erjedés. Mindkét folyamatban a szőlőcukor átalakítása zajlik enzimek által katalizált, számos lépésben. Ezt a szerves anyagot a sejtek a vérből veszik fel, ahol átlagos mennyisége 1,00 g/dm3. Egy felnőtt ember teljes vérmennyisége átlagosan 5,50 liter. A szőlőcukrot a szervezet az étkezések közötti időszakokban a májban és az izmokban tárolja glikogén formájában. A biológiai oxidáció sokkal hatékonyabb energiatermelő folyamat. Erre akkor kerülhet sor, ha a szervezetben elegendő oxigén áll rendelkezésre. Ilyenkor a cukor szén-dioxiddá és vízzé ég el.
Egy 14 év feletti, egészséges férfi átlagos nehézségű munkavégzés mellett napi 12000 kJ, egy nő napi 10000 kJ hasznosítható energiát igényel.
ΔkH (CO2)= -394 kJ/mol ΔkH (H2O, f)= -286 kJ/mol ΔkH (szőlőcukor)= -1271 kJ/mol
a) Adja meg a glükóz képletét! Írja fel a biológiai oxidáció reakcióegyenletét! Számítsa ki a folyamat reakcióhőjét!
b) Adja meg a vércukorszint átlagos értékét mmol/l-ben!
c) Hány g szőlőcukrot kell elégetnie egy átlagos nehézségű munkát végző férfi szervezetének egy nap alatt, ha feltételezzük, hogy energiaszükségletét csak ebből fedezi? (Tegyük fel, hogy a felszabaduló energiát a szervezet 100%-ban hasznosítja.)
4/k-5 (2008. október, 8. feladat)
A N2O (kéjgáz) színtelen, édeskés szagú gáz, altatószerként és habszifonok patronjának töltőgázaként is használják. Fagylaltok és tejszín habosítására alkalmazható azon tulajdonsága alapján, hogy nyomás alatt oldódik növényi zsírokban, valamint íztelen, kis mennyiségben pedig nem mérgező. Ammóniával robbanóelegyet képez, miközben elemi nitrogén és vízgőz keletkezik. Könnyen előállítható a pétisó hatóanyagának (ammónium-nitrát) óvatos (250 ºC-os) hevítésével, miközben a melléktermék víz.
a) Egy habszifon patronjának töltőtömege 5,50 gramm. Számítsa ki, hány darab molekulát jelent ez!
b) Írja fel a kéjgáz előállításának egyenletét! Számítsa ki, hogy mekkora tömegű ammónium-nitrát hevítésével állítható elő 10 darab patron megtöltéséhez szükséges kéjgáz!
c) Írja fel és rendezze a kéjgáz ammóniával való robbanásának reakcióegyenletét, és számítsa ki a reakcióhőt!
ΔkH [NH3(g)] = – 46,0 kJ/mol, ΔkH [H2O(g)] = – 242 kJ/mol,
ΔkH [H2O(f)] = – 286 kJ/mol, ΔkH [N2O(g)] = + 82,0 kJ/mol.
4/k-6 (2009. május, 7. feladat)
1936-ban figyelte meg Otto Hahn és Fritz Strassmann, hogy a 235U-t lassú neutronokkal bombázva az urán atommag két, a periódusos rendszernek kb. a közepére eső magra és több neutronra esett szét. A jelenséget maghasadásnak nevezte el. A lejátszódó reakció:
92235U + 01n → 92236U → 3690 Kr + 56143Ba + 3 01n ΔrH = –1,90⋅1010 kJ/mol
A maghasadás során jelentős mennyiségű energia szabadul fel. A maghasadás során több neutron termelődik, mint amennyi a folyamat megindításánál elhasználódik. A termelődő többletet felhasználhatják újabb magok hasadásának kiváltásához. Megfelelő tömegű 235U esetén a láncreakció önfenntartóvá válik.
Az atomreaktorokban a hasadóanyagból felszabaduló hőt alakítják át elektromos árammá. Vigyáznak arra, hogy a reaktorban csak a szükséges mennyiségű energia szabaduljon fel, ezért a láncreakciót szabályozzák.
Ar(H) = 1,000, Ar(C) = 12,00, Ar(235U) = 235
ΔkH (CO2(g)) = –394 kJ/mol,
ΔkH (H2O(f)) = –286 kJ/mol,
ΔkH (oktán(g)) = –209 kJ/mol
ρ(oktán) = 0,703 g/cm3
a) Mit nevezünk izotópnak? A fenti szövegből írjon példát izotópokra és adja meg azok proton- és neutronszámát!
b) 1,00 g 235U-izotóp maghasadásakor mennyi energia szabadul fel?
c) Mennyi energia szabadul fel 1,00 liter (1,00 l = 1,00 dm3) benzin elégése során (25 °C-on, standard nyomáson), ha feltételezzük, hogy csak oktánból áll?
d) Hány liter (csak oktánból álló) benzin égése során szabadul fel annyi energia, mint 1,00 g 235U maghasadásakor?
4/k-7 (2009. október, 8. feladat)
Az etanol és a metanol kitűnő oldószerek, sokféle szerves vegyület kiindulási anyagai, valamint üzemanyagként és üzemanyag adalékként is felhasználják őket.
Tételezzük fel, hogy 100%-os metanollal, illetve etanollal működő járműveket tervezünk, és azt kell igazolnunk, hogy elméletileg az etanol vagy a metanol használata gazdaságosabb! A fellépő energiaveszteségtől is eltekintünk számításaink során!
Vizsgáljuk továbbá, hogy melyik anyag felhasználása terheli jobban a környezetet a széndioxid kibocsátással!
Munkánkhoz az alábbi adatokat használjuk fel:
A 100%-os metanol sűrűsége: 0,791 g/cm3, a 100%-os etanol sűrűsége: 0,789 g/cm3.
| Anyag | Képződéshő (kJ/mol) |
| CH3OH(f) | – 238,8 |
| C2H5OH(f) | – 277,8 |
| CO2 (g) | – 394,0 |
| H2O ( g) | – 242,0 |
2 CH3OH (f) + 3 O2 (g) = 2 CO2 (g) + 4 H2O (g)
C2H5OH (f) + 3 O2 (g) = 2 CO2 (g) + 3 H2O (g)
a) Számítsa ki, mekkora térfogatú standard nyomású és 25,0 °C-os szén-dioxid termelődik 100,0-100,0 cm3 metanol, illetve etanol elégetése során!
b) Számítsa ki a tökéletes égési folyamatokhoz tartozó reakcióhőket!
c) Számítsa ki, mekkora energia szabadul fel 100,0-100,0 cm3 metanol, illetve etanol tökéletes égése során!
d) Számításai alapján, azonos (egységnyi) térfogatú kibocsátott szén-dioxidra vonatkoztatva melyik üzemanyag ad több energiát?
4/k-8 (2010. május, 8. feladat)
A fotoszintézis során szén-dioxidból és vízből szerves anyagok képződnek fényenergia hatására, miközben oxigén keletkezik. A folyamat leegyszerűsített bruttó (rendezendő) egyenlete az alábbi módon adható meg:
CO2(g) + H2O(f) à C6H12O6(sz) + O2(g)
Ar(H) = 1,000, Ar(C) = 12,00, Ar(O) = 16,00
Ismertek az alábbi adatok:
| CO2(g) | H2O(f) | C2H5OH(f) | C6H12O6(sz) | |
| Képződéshő (kJ/mol) | –394,0 | –286,0 | –278,0 | –1275 |
a) Határozza meg a fotoszintézis reakcióhőjét!
b) Elvileg mekkora energia szükséges 1,000 kg szőlőcukor fotoszintézis során való keletkezéséhez?
c) A bor képződésekor, a többek között fotoszintézissel keletkező szőlőcukor alkoholos erjedéssel alkohollá alakul. Írja fel az alkoholos erjedés rendezett reakcióegyenletét!
d) Számítsa ki az erjedés reakcióhőjét! A fotoszintézisnél beépült energia hány százaléka szabadul fel az alkoholos erjedés során?
4/k-9 (2010. október, 8. feladat)
Egy telített szénhidrogén 83,3 tömeg% szenet és 16,7 tömeg% hidrogént tartalmaz.
A szénhidrogén 14,4 g-ját tökéletesen elégetjük. Ar(H) = 1,00, Ar(C) = 12,0
| Vegyület neve | ΔkH (kJ/mol) | Vegyület neve | ΔkH (kJ/mol) |
| Metán (g) | – 74,4 | Ciklopentán (g) | – 76,3 |
| Etán (g) | – 83,3 | Hexán (f) | –167 |
| Etén (g) | 52,5 | Heptán (f) | –188 |
| Propán (g) | –105 | Oktán (f) | –209 |
| Propén (g) | 20,0 | Nonán (f) | –228 |
| Propin (g) | 185 | Benzol (f) | 82,6 |
| Bután (g) | –126 | Toloul (f) | 111 |
| Butin (f) | 141 | Szén-dioxid (g) | –394 |
| Pentán (g) | –147 | Víz (f) | –286 |
a) Mi a szénhidrogén molekulaképlete?
b) Írja fel a tökéletes égés egyenletét!
c) Számítsa ki a szénhidrogén égésének reakcióhőjét a táblázat adatait felhasználva!
d) Mennyi hő szabadul fel a 14,4 g szénhidrogén elégetése során?
4/k-10 (2012. május, 6. feladat B)
Egy edényben 12,0 mol szén-monoxid-gázt és 4,00 mol oxigéngázt elegyítettünk, és egy szikra hatására a két gáz reagált egymással. Ar(C) = 12,0, Ar(O) = 16,0, ΔkH (CO(g)) = –113,4 kJ/mol, ΔkH (CO2(g)) = –394,4 kJ/mol
a) Számítsa ki a kiindulási gázelegy tömeg%-os összetételét!
b) Számítsa ki a kapott gázelegy anyagmennyiség%-os összetételét!
c) Számítsa ki, hogy mekkora energiaváltozás kísérte a fenti folyamatot!
4/k-11 (2012. október, 8. feladat)
Az élelmiszerek energiatartalmát „kalóriával” jellemezzük, ami valójában az a hőenergia, ami a szervezetben történő égésük során felszabadul. A felszabaduló hő mértékegysége korábban a kilokalória (kcal) volt, azonban az SI mértékegység-rendszer bevezetése óta a hivatalos nemzetközi egysége a joule (J), illetve a kilojoule (kJ); 1 kcal 4,18 kJ-nak felel meg. Az élelmiszerekben az energiát adó tápanyagok a szénhidrátok, zsírok és fehérjék.
Egy 25 éves kb. 60 kg testtömegű fiatalnak, ha átlagos napi mozgást végez, kb. 2200 kcal energiára van szüksége.
Valamely üdítőital répacukor-tartalma 11,2 g / 100 cm3, és más energiát adó tápanyagot nem tartalmaz.
ΔkH (szacharóz) = –2218 kJ/mol, ΔkH (CO2(g)) = –394 kJ/mol, ΔkH (H2O(f)) = –286 kJ/mol
Ar(H) = 1,00, Ar(C) = 12,0, Ar(O) = 16,0
a) Mennyi kalóriát „fogyasztunk” el, ha a fenti üdítőből fél litert (0,500 l) (1 liter = 1 dm3) megiszunk? (Feltételezzük, hogy a cukor répacukor (szacharóz) formájában van az üdítőitalban.) Írja fel a szacharóz égésének reakcióegyenletét és számítsa ki a reakcióhőket is!
b) Fél liter üdítőital az átlagosan szükséges napi energiamennyiségnek hány %-át teszi ki?
4/k-12 (2014. május, 7. feladat)
Az akroleint, a zsírok, olajok hőbontásakor keletkező szerves, mérgező folyadékot az ipar nagy mennyiségben használja a plexigyártás alapanyagaként. Használják még az öntöző csatornákban gyomirtó szerként is, de ez az anyag szennyezheti a pálinkát is, ha azt földdel szennyezett cefréből főzik.
a) Számítással határozza meg az akrolein tapasztalati képletét, ha tömegszázalékos összetétele a következő: C: 64,29 % H: 7,14 % O: 28,57 %
b) Határozza meg az akrolein molekulaképletét, ha tudjuk, hogy molekulája egyetlen oxigénatomot tartalmaz! Rajzolja fel a lehetséges konstitúciós képletet is, ha tudjuk, hogy formilcsoportot tartalmaz!
c) A megadott adatok segítségével számítsa ki, hogy 10,0 cm3 akrolein tökéletes elégetésekor mennyi hő szabadul fel!
ρ(akrolein) = 0,840 g/cm3 ΔkH (akrolein) = –74,0 kJ/mol
ΔkH (CO2(g)) = –394 kJ/mol ΔkH (H2O(f)) = –286 kJ/mol
4/k-13 (2015. október, 8. feladat)
Az alumíniumot – legtöbbször termitreakciók során – gyakran más fémek (pl. V, Cr, W, Mn) ipari előállítására is alkalmazzák. A redukálandó fém-oxidot alumíniumporral összekeverik, s a reakciót valamilyen gyújtókeverék segítségével indítják meg. Erősen exoterm folyamatról van szó, melyben a fém mellett alumínium-oxid is keletkezik. A mangán előállításánál mangán(IV)-oxid (MnO2) és alumíniumpor reakciójából indulnak ki.
a) Írja fel a reakció rendezett egyenletét!
A vas is előállítható termitreakcióval. E folyamatot a vas ipari előállítására nem használják, de laboratóriumban leggyakrabban így szokták a termitreakciókat bemutatni. A folyamat az alábbi reakcióegyenlet szerint játszódik le:
2 Al + Fe2O3 = 2 Fe + Al2O3
b) Számítsa ki a folyamat reakcióhőjét a megadott adatok alapján!
(ΔkH (Al2O3(sz)) = –1671 kJ/mol; ΔkH (Fe2O3(sz)) = –823 kJ/mol)
30,0 g vas(III)-oxidhoz 8,10 g alumíniumport kevertek és megindították a reakciót.
c) Számítsa ki, mekkora tömegű vas(III)-oxid maradt átalakulatlanul!
d) Számítsa ki, mekkora hő szabadult fel a reakció során!
4/k-14 (2016. május, 8. feladat)
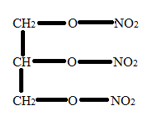
A nitroglicerin egy nagyon hatékony robbanószer.
Képlete:
 Robbanása ütés, vagy egy erősebb hanghatás következtében is végbemegy. A robbanáshoz nincs szükség oxigénre, mert bomlási folyamat megy végbe: szén-dioxid-gáz, vízgőz, nitrogén- és oxigéngáz képződik. A robbanás nemcsak a reakció exoterm voltával magyarázható, hanem azzal is, hogy nagyon nagy anyagmennyiségű gázmolekula képződik a folyamatban, ami a nyomás növekedésével erősen hozzájárul az explozív hatáshoz.
Robbanása ütés, vagy egy erősebb hanghatás következtében is végbemegy. A robbanáshoz nincs szükség oxigénre, mert bomlási folyamat megy végbe: szén-dioxid-gáz, vízgőz, nitrogén- és oxigéngáz képződik. A robbanás nemcsak a reakció exoterm voltával magyarázható, hanem azzal is, hogy nagyon nagy anyagmennyiségű gázmolekula képződik a folyamatban, ami a nyomás növekedésével erősen hozzájárul az explozív hatáshoz.
a) Írja fel a nitroglicerin robbanása során végbemenő reakció rendezett egyenletét!
b) Hasonlítsa össze a nitroglicerin robbanásának, és egy tűzveszélyes anyag, a dietil-éter tökéletes égésének energiaviszonyait!
Írja fel a dietil-éter égésének termokémiai reakcióegyenletét!
Számítsa ki mindkét reakció esetében a reakcióhőt, és határozza meg, mennyi hő szabadul fel 1,00 g nitroglicerin robbanásakor, illetve 1,00 g éter tökéletes égésekor!
(A nitroglicerin képződéshője –370 kJ/mol, a dietil-éteré –272 kJ/mol, a vízgőzé –242 kJ/mol, a szén-dioxidé –394 kJ/mol)
c) Számítsa ki a termékek és a kiindulási anyagok anyagmennyiségének hányadosát a nitroglicerin robbanására, illetve a dietil-éter tökéletes égésére!
Állapítsa meg (az éterrel összehasonlítva), hogy a reakcióhő értéke, vagy a molekulák számának növekedése felelős inkább a nitroglicerin robbanó hatásáért!
4/k-15 (2017. május, 5. feladat)
Egy 45,0 térfogatszázalék propánt és 55,0 térfogatszázalék butánt tartalmazó gázelegyet tökéletesen elégetünk. A folyamat végén a képződő vízgőz lecsapódik.
ΔkH (propán(g)) = –104 kJ / mol; ΔkH (bután(g)) = –144 kJ / mol
ΔkH (CO2(g)) = –394 kJ / mol; ΔkH (H2O(f)) = –286 kJ / mol
a) Írja fel az égési reakciók rendezett egyenletét!
b) Számítsa ki a felírt reakcióegyenletekhez tartozó reakcióhőket!
c) Számítsa ki 2,00 m3, 25 °C hőmérsékletű, standard nyomású gázelegy elégetése során felszabaduló hőmennyiséget!
4/k-16 (2019. május, 5. feladat B)
A flambírozás során az ételt alkoholtartalmú folyadékkal leöntik, majd meggyújtják. Ez az eljárás igen látványossá tudja tenni bizonyos ételek felszolgálását. Az etil-alkohol és víz elegye az összetételtől függően gyújtható meg. Az alkohol égésekor keletkező hőnek biztosítania kell a víz elpárologtatásához szükséges hőmennyiséget. Ha ez a feltétel megvalósul, az elegyet meg lehet gyújtani.
A számításokhoz (a moláris tömegeken kívül) a következő adatok állnak rendelkezésre:
ρ(etanol) = 0,789 g/cm3 ρ(víz) = 1,00 g/cm3
ΔkH (CH3CH2OH(f)) = – 278 kJ/mol ΔkH (H2O(g)) = – 242 kJ/mol
ΔkH (CO2(g)) = – 394 kJ/mol A víz párolgáshője + 44 kJ/mol
a) Adja meg a cseppfolyós víz képződéshőjét!
b) Írja fel az etil-alkohol tökéletes égésének reakcióegyenletét, és határozza meg az egyenlethez tartozó reakcióhőt, ha tudjuk, hogy az égetés során vízgőz keletkezik!
c) Tételezzük fel, hogy az alkohol égetéséből származó hőnek csupán 15,0 %-a fordítódik az elegyben lévő víz elpárologtatására. 100 cm3 alkoholhoz maximum mekkora térfogatú vizet keverhetünk, hogy az elegy begyújtható legyen? Adja meg az így kapott elegy tömegszázalékos összetételét is!