Sztöchiometria – Elméleti összefoglaló
Redoxireakciók
- Elektronátmenettel járó kémiai reakció
- 2 részecske találkozik → az egyiknek vannak olyan elektronjai, amelyektől képes megválni, a másiknak pedig szüksége van elektronokra
- Az a részecske, amelyik elektront ad le oxidálódik, amelyik elektront vesz fel redukálódik
- oxidáció = elektron leadás
- redukció = elektron felvétel
- A két folyamat egy időben zajlik
- az a részecske, mely oxidálódik, redukcióra készteti a másikat
- az a részecske, mely redukálódik, oxidációra készteti a másikat
- redukálószer = oxidálódó részecske
- oxidálószer = redukálódó részecske
- A redoxireakciókban mind a 3 kötéstípus (fémes, ionos, kovalens) részt vesz
- Az ionos kötés kialakítása esetén, amelyik részecske kationt képez, az oxidálódik, mert elektron ad le, amelyik részecske aniont képez, az redukálódik, mert elektront vesz fel:
- Fémeknél, ha a fémrészecske pozitív vagy pozitívabb lesz, akkor oxidálódik, ellenétes esetben redukálódik:
- Molekulák esetében nem mindig könnyű, sőt legtöbb esetben nehéz eldönteni, hogy melyik atom milyen szerepet tölt be → ezért jöttek létre az oxidációs számok
- Az oxidációs szám egy fiktív, mértékegység nélküli mennyiség, annak a relatív töltésnek a számértéke, amelyet akkor kapnánk, amikor a kovalens kötésben lévő nagyon elektronegativitású atomhoz hozzárendeljük a nem kötő elektron-párjai mellé a kötésben lévőket
- Szabályok:
- a fluor oxidációs száma mindig -1
- semleges atomok oxidációs száma 0
- egyszerű ionok oxidációs száma megegyezik a töltésükkel
- a hidrogén oxidációs száma általában +1, kivétel a hibridekben, ahol -1
- az oxigén oxidációs száma általában -2, kivétel a peroxidokban, ahol -1, és a szuperoxidokban, ahol -0,5 (F2O molekulában +2)
- halogének oxidációs száma -1, oxigénnel alkotott vegyületeikben többféle lehet
- semleges molekulákban az alkotó atomok oxidációs számának összege 0
- összetett ionok esetében az alkotó atomok oxidációs számának összege megegyezik az ion töltésével
- Ha a kémia reakcióban van olyan atom, amelynek változik az oxidációs száma, akkor redoxireakcióról beszélünk
- oxidáció = oxidációs szám növekedés
- redukció = oxidációs szám növekedés
- Egyenletrendezésnél két szempontot kell figyelembe venni: a tömegmegmaradást és a töltésmegmaradást
- Vizet és H-iont mindig hozzá lehet adni valamelyik oldalhoz
- Esetek:
- az egyenletben az egyik atom oxidációs száma nő, a másiké csökken
- az egyik atom oxidációs száma kettéválik: egyik része nem változik, másik része oxidálódik vagy redukálódik
- szinproporció: az a jelenség, amikor egy kémiai reakció során egy magasabb és egy alacsonyabb oxidációs számú anyagból közös oxidációs számú anyag keletkezik
- diszproporció: az a jelenség, amikor egy kémiai reakció során az abban résztvevő egy vagy több elem redukálódik és oxidálódik egyszerre
- 3 anyag változik
Gázkeverékek
- Ideális gáz: a kölcsönhatások elhanyagolhatóak, ezért korlátlanul elegyednek, térfogatuk összeadható
- Avogadro-törvénye: a gázok megegyező térfogata azonos körülmények között, azonos számú részecskét tartalmaznak
- Moláris térfogat: egy mól gáz (anyagmennyiségtől függetlenül, azonos körülmények között) kitöltött térfogata:
- standard nyomás, 0 oC-on Vm = 22,41 dm3/mol normál állapot
- standard nyomás, 20 oC-on Vm = 24 dm3/mol
- standard nyomás, 25 oC-on Vm = 24,5 dm3/mol standard állapot
- Gázelegyek összetétele: Általában térfogatszázalékban, vagy mólszázalékban adjuk meg, ami a gázoknál megegyezik
- Átlagos moláris tömeg: ∑𝑖 x𝑖 · M𝑖 = 𝑃
- Relatív sűrűség:
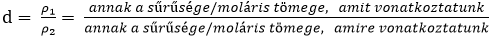
Titrimetria
- Koncetráció mérésre jó → az ismeretlen koncentrációjú, de ismert térfogatú anyagot egy jól megválasztott reakció partnerrel reagáltatjuk és annak a mennyiségét mérjük
- Sav-bázis titrálás: sav vagy lúg koncentrációja a kérdés
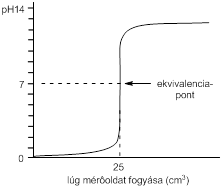
- HCl + NaOH = NaCl + H2O
- A HCl mennyisége folyamatosan csökken, míg a NaCl-é folyamatosan nő, ezzel egyidőben a pH is növekszik, amikor elérünk a 7-es pH-hoz, akkor a HCl mennyisége teljesen elfogyott. (Ekvivalencia pont)
- Ezt a pH változást egy jól megválasztott indikátor segítségével láthatjuk
- Redoixititrálás: oxidáló vagy redukálószer koncentrációja a kérdés
- Bizonyos esetekben nem áll módunkban egyszerű titrálást végezni, mert pl. a reakció túl lassú, vagy elbomlik az anyag
- Visszatitrálás: a meghatározandó oldathoz feleslegben adunk ismert mennyiségű segédmérőoldatot, majd a segédmérőoldat feleslegét titráljuk egy mérőldattal
Feladatok
FEB-es feladatok
Közép szintű érettségi feladatok
Emelt szintű érettségi feladatok
OKTV feladatok